蛋白互作检测之磁珠法Co-IP技术
蛋白是基因功能的执行者,是基因发挥功能的关键分子。不同蛋白质之间通过蛋白质相互作用(protein-protein interaction,PPI)形成互作网络参与生物信号传递、基因表达调节、能量和物质代谢及细胞周期调控等生命过程。深入解析PPI网络对揭示蛋白质在生物过程中的功能,阐明疾病等特殊生理状态下生物信号和能量物质代谢的反应机制具有重要意义。今天将为大家分享生物研究中常用蛋白质互作检测技术和方法,与大家共同学习耳熟能详的免疫共沉淀技术(Co-IP)及相关的免疫沉淀-质谱技术(Co-IP-MS),欢迎点赞关注,多多交流指正。
免疫沉淀(Immunoprecipitation,IP)是基于抗原-抗体特异性结合的特性,利用抗体将目的蛋白从复杂样本中富集出来的一种生物学手段。由此衍生出来的免疫共沉淀(Co- Immunoprecipitation,Co-IP)则是基于IP的原理,研究蛋白质相互作用的一种手段,能够有效确定两种蛋白质在细胞内的生理性相互作用,是蛋白互作检测的金标准。
一. Co-IP实验的主要原理
Co-IP实验的主要原理是利用抗原-抗体特异性结合的特性,将特异性抗体加入到含有目的蛋白样本溶液中,抗体与目的蛋白特异性结合。Protein A/G融合Protein A和Protein B的IgG结合结构域,能与抗体的Fc片段特异性结合,因此利用固定在磁珠上的Protein A/G可以与目的蛋白-抗体复合物结合形成复合体。最终通过离心或磁分离、收集、洗脱、溶解等步骤获得目的蛋白以及与目的蛋白互作的蛋白质,实现从复杂样本中富集目的蛋白及相关互作蛋白。
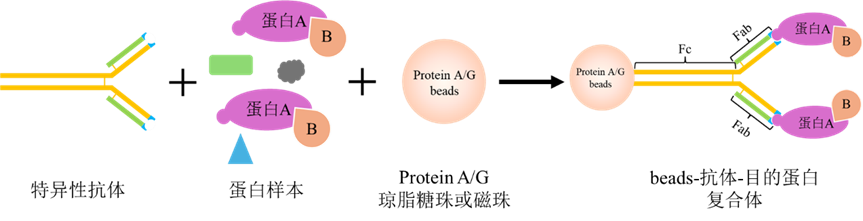
免疫沉淀原理示意图(图片来源于网络)
二. Co-IP的技术特点
1. 技术优势
体内天然状态下验证互作,接近正常生理水平;蛋白处理细胞生理环境下,避免人为干扰;分离天然状态下的蛋白进行功能检测。
2. 技术不足
无法检测弱相互作用和瞬时相互作用;检测直接相互作用,对于间接相互作用检测效果差;对抗体要求高。
三. Co-IP的实验前准备
1、蛋白裂解液选择
为避免破坏蛋白相互作用,Co-IP实验对蛋白裂解液具有一定要求:
(1)使用非变性温和裂解液;
(2)使用温和的非离子去垢剂如NP-40,Triton X-100,避免使用SDS等离子型去垢剂。
2、抗体选择
(1)选择经过IP验证的抗体,从而识别目的蛋白天然构象;
(2)若无合适的IP级别抗体,则可添加标签蛋白,使用IP级别的标签抗体进行相关实验;
3、固相支持物选择
Co-IP实验常用固相支持物主要有琼脂糖珠和磁珠两种(具体请参考网页http://www.purimagbead.com/Product/0293713052.html),二者主要区别为:
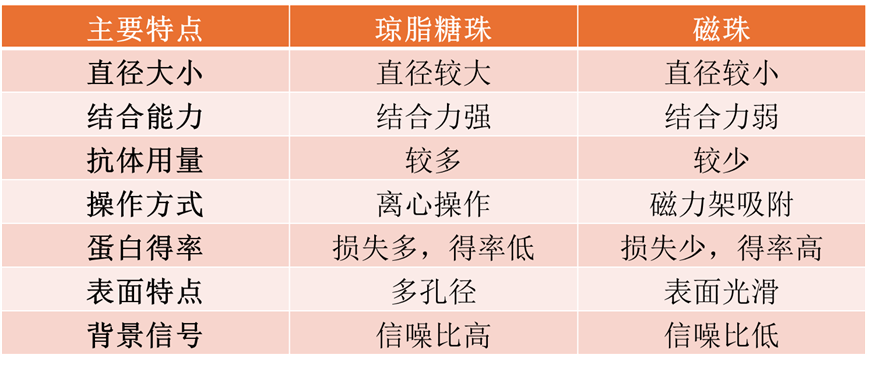
4、洗脱方式
不同洗脱液对于蛋白构象和相互作用影响较大,Co-IP实验需根据不同实验需求选择不同洗脱方式:
(1)非变性洗脱:通常使用低pH洗脱液进行洗脱(如pH 2.5-3.0的0.1 M甘氨酸溶液),此类洗脱方式能够保留蛋白质的天然结构,便于蛋白的功能验证如酶活检测;
(2)变性洗脱:通常使用蛋白上样缓冲液进行洗脱,此类洗脱方式会破坏蛋白结构,通常用于互作蛋白鉴定如Western blot。
四. Co-IP的实验流程
1、根据实验需求对培养细胞并进行相应处理(如细胞转染、药物处理等);
注意:若是组织样本,则对组织破碎后直接跳转到步骤3。
2、收集处理后的细胞并吸弃培养基,刮下细胞并收集于1.5 mL离心管中,4 ℃, 1000 rpm条件下离心5 min,弃上清;
3、使用4 ℃预冷的PBS洗涤细胞3次,4 ℃, 500 g条件下离心5 min,弃上清;
注意:
(1)IP实验流程需在冰上进行,避免蛋白出现降解;
(2)实验中的试剂使用前需在4 ℃预冷处理;
4、加入500 μL含蛋白酶/磷酸酶抑制剂的IP裂解液,轻轻吹打混匀后置于冰上裂解细胞30 min;
注意:
(1)IP裂解液根据样本量使用,避免裂解不彻底或者目的蛋白浓度过低;
(2)保证加入蛋白酶/磷酸酶抑制剂,避免目的蛋白降解;
(3)保证裂解时间充足,避免裂解不彻底;
(4)裂解时可将样本置于摇床,增加裂解液与样本接触面积;
5、裂解完成后,4 ℃,12000 rpm条件下离心30 min,取上清转移至新的1.5 mL EP管中;
6、预留20 μL上清液作为WB的Input样本,剩余上清中加入适量抗体,轻轻吹打混匀后4 ℃翻转摇床孵育过夜或常温翻转孵育2 h;
注意:
(1)需使用IP级别抗体,最好为单抗,避免非特异性结合;
(2)建议4 ℃翻转孵育过夜,低温有助于降低非特异性结合;
(3)抗体按照说明书确定用量,避免用量过多导致非特异性结合;
(4)可将上清溶液分为两份,一份加入特异性抗体作为IP组,另一份加入与特异性抗体同源的IgG抗体作为阴性对照组(IgG组)
7、取适量Protein A/G beads并利用IP裂解液清洗3遍;
注意:
(1)储存珠子的液体与IP实验不兼容,使用时需对beads进行清洗;
(2)取珠子时可将枪头稍微剪成适当大小斜口,避免珠子堵塞枪头或者枪头破坏珠子;
(3)磁珠和琼脂糖珠与抗体结合条件不同,需根据珠子类型选择合适孵育时间;磁珠常温下旋转孵育20 min即可,琼脂糖珠则通常在4 ℃旋转孵育1-4 h;
8、将清洗后的Protein A/G beads(以琼脂糖珠为例)加入抗体孵育完成后的溶液中,4 ℃翻转摇床孵育1-4 h;
注意:
(1)需保证足量的beads,避免beads用量不足以结合抗体-目的蛋白复合物;
(2)beads孵育时间可通过预实验进行调整,避免因孵育时间过短或过长导致富集效果差或者非特异性结合;
9、Protein A/G beads孵育完成后,4 ℃,2000 rpm条件下离心5 min,收集beads;
10、加入1 mL IP裂解液,轻柔颠倒混匀后置于冰上静置2-3 min洗涤protein A/G-beads,4 ℃,2000 rpm条件下离心5 min,收集beads;
12、重复步骤10,洗涤beads 10次;
注意:
(1)步骤9-12需轻柔进行,避免破坏beads-抗体-目的蛋白复合体;
(2)清洗次数会影响最终结果,清洗次数过多会导致弱结合蛋白被洗脱,检测信号弱;清洗次数过低会导致非特异性结合未被清洗干净,信噪比高;
13、根据检测方法选择合适的洗脱方法对beads上的蛋白进行洗脱,最终获得目的蛋白;
注意:
(1)抗体和beads为非共价结合,会一同被洗脱;
(2)Western blot实验通常使用3×蛋白上样缓冲液进行洗脱,洗脱效率高,可同时对蛋白变性处理,便于后续检测;
(3)若进行其他检测如酶活性检测,则需使用兼容下游实验的洗脱缓冲液进行洗脱;
14、利用Western blot或者质谱分析的方法对目的蛋白进行检测;
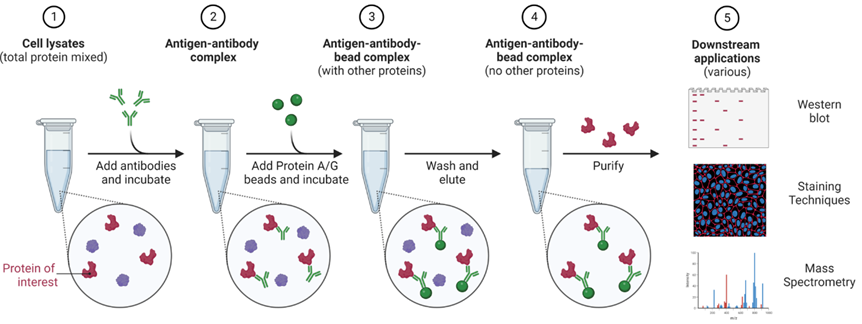
IP实验流程示意图
五. Co-IP的实验结果判读
1、已知蛋白互作验证(内源蛋白)
对于已知蛋白是否存在相互作用,通常利用Western blot进行检测,实验通常包含Input样本、IgG样本以及IP样本,其中Input样本和IgG样本分别可作为阳性对照和阴性对照,IP样本则用于检测蛋白是否存在互作。
Input组:阳性对照组,抗体富集前预留样本,检测蛋白A和B的表达情况;
IgG组:阴性对照组,无条带,用于排除IP组出现非特异性条带;
IP组:实验组,用于检测蛋白A和蛋白B是否存在互作。

上图检测内源蛋白A和蛋白B是否互作。Input组蛋白A和蛋白B均正常检出目的条带,表明蛋白A和蛋白B表达正常,抗体有效;IgG组未检出条带,表明抗体无非特异结合;利用蛋白A的抗体进行IP富集,蛋白A表达较Input组明显增多,表明对蛋白A富集成功。图(左)中蛋白B检出条带,证明用抗体A富集后的样本中包含蛋白B,蛋白A和蛋白B存在相互作用。图(右)中蛋白B未检出条带,证明用抗体A富集后的样本中不包含蛋白B,蛋白A和蛋白B不存在相互作用。
注意:Co-IP实验通常进行正拉(抗体A富集检测蛋白B)和反拉(抗体B富集检测蛋白A)实验进行互作检测,两次结果结尾阳性时证实蛋白A和蛋白B存在相互作用。
2、已知蛋白互作验证(外源质粒高表达)
对于转染基因表达质粒时,样本通常分为3组,Protein A、Protein B以及Protein A+ Protein B,可使用IgG作为阴性对照,对于目的蛋白无IP级别抗体时可使用标签抗体进行相关检测。
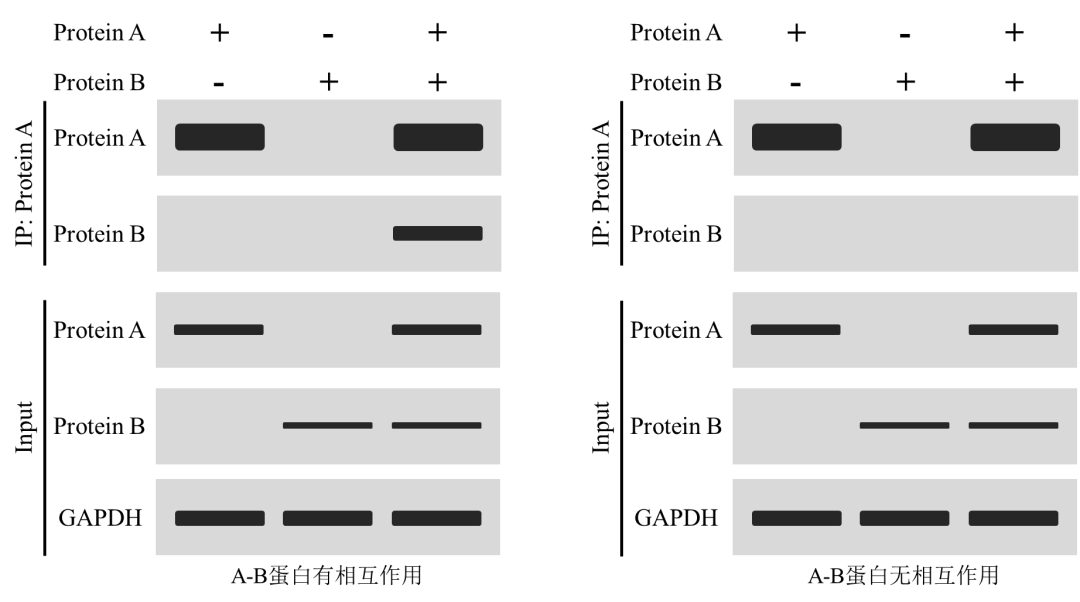
上图为分别转染基因A和基因B表达质粒后分析蛋白A和蛋白B是否互作。图中Input结果内参蛋白GAPDH均检出条带,表明蛋白提取过程正常,蛋白A和蛋白B均检测目的条带,表明质粒正常表达;图(左)中,利用蛋白A的抗体进行富集,蛋白A组和Protein A + Protein B组中均可检出蛋白A条带,表明蛋白A抗体IP富集成功,Protein A + Protein B组中检测蛋白B条带,证明用抗体A富集后的样本中包含蛋白B,蛋白A和蛋白B存在相互作用。图(右)Protein A + Protein B组中未检出蛋白B条带,证明用蛋白抗体A富集后的样本中不包含蛋白B,蛋白A和蛋白B不存在相互作用。
3、未知互作蛋白筛选
对于筛选与目的蛋白存在相互作用的潜在蛋白,通常利用质谱技术进行分析。首先利用Western blot技术对IP结果进行检测,确认抗体成功富集目的蛋白后对样本进行质谱分析。Western blot检测包含Input样本、IgG样本以及IP样本,其中Input样本和IgG样本分别可作为阳性对照和阴性对照,IP样本则用于检测蛋白富集效果;质谱分析时可将IgG样本作为阴性对照,排除假阳性信号。
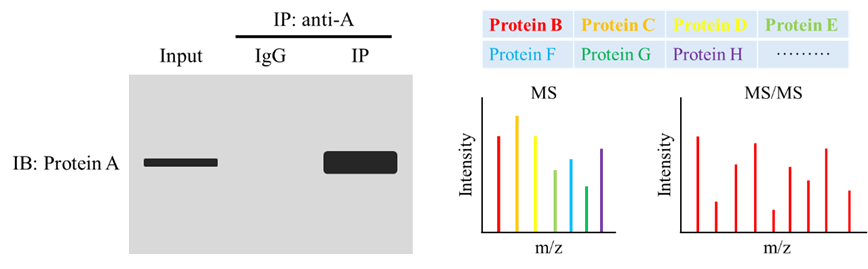
如上图所示,Input组蛋白A正常检出目的条带,表明蛋白A表达正常,抗体有效;IgG组未检出条带,表明抗体无非特异结合;利用蛋白A的抗体进行IP富集,蛋白A表达较Input组明显增多,表明对蛋白A富集成功。随后对IP富集后的beads进行蛋白洗脱后质谱鉴定除Protein B、Protein C等,后续可通过Co-IP对感兴趣的蛋白进行进一步互作验证。
厦门普睿迈格生物科技有限公司提供各类磁珠http://www.purimagbead.com/Product/,用于化学生物学研究。
六. Co-IP的实验问题与分析
1、Co-IP结果无信号
原因1:目的蛋白表达低,或者IP富集效果差
根据Input组和IP组目的蛋白检测结果分析原因,酌情考虑使用外源表达质粒进行目的基因高表达或者加大用于IP富集的蛋白裂解物。
原因2:蛋白互作程度低
使用外源质粒对互作蛋白高表达,增加蛋白裂解样的使用,或者使用适当手段诱导互作。
原因3:裂解液使用不当
变性裂解液会破坏蛋白相互作用,建议使用温和型非变性裂解液处理样本,操作过程中尽量轻柔,避免破坏蛋白相互作用。
原因4:抗体使用不足或者效用差
通过根据Input结果分析抗体效用,若抗体工作效果较好,则可增加IP过程中抗体用量。
原因5:beads与抗体结合效果差
根据实验需求选择适合的琼脂糖珠或者磁珠,并且使用beads前检测beads是否保存不当导致过期或者失效。
2、Co-IP结果杂带多,背景干扰严重
原因1:beads结合后洗涤次数不足,清洗不彻底
增加洗涤次数,适当梯度增加洗涤液中NaCl和去垢剂的浓度。
原因2:抗体特异性差或者IP富集时抗体浓度过高
分析Input组条带信号,根据Input结果考虑降低IP富集时抗体使用浓度或者更换抗体。
原因3:IP富集时样本用量过多或者实验过程中蛋白降解
根据实验结果适当减少细胞裂解样本量,并且保证实验过程在冰上进行,裂解液中加入足量蛋白酶抑制剂和磷酸酶抑制剂。
原因4:洗脱后的WB检测实验过程中操作不规范
严格按照WB实验流程,注意转膜时间、膜封闭条件、一抗和二抗稀释比例、孵育时间等,一抗孵育建议4℃过夜进行,低温有助于降低非特异性结合。
原因5:抗体重链或者轻链干扰
IP实验出现非特异性条带位置位于55 kDa附近或者25 kDa附件时可考虑IgG重链或者轻链的干扰。对于此类情况,尽量在IP富集与WB检测时选择不同种属来源的抗体(例如IP抗体为兔抗,WB抗体则选择鼠抗)。
3、IgG组中检出非特异性条带
原因1:IgG与非特异性抗体结合
若IgG组中检出非特异性条带,可适当增加beads清洗次数以及洗涤液中NaCl和去垢剂的浓度;或者适当降低抗体使用浓度;
原因2:IgG抗体自身问题
更换阴性对照的IgG抗体,或者在IP富集与WB检测时选择不同种属来源的抗体。
七. Co-IP技术应用案例
1、验证蛋白-蛋白相互作用


Co-IP检测内源性STX11和SNAP25蛋白相互作用。Input组检出STX11和SNAP25目的蛋白,表明抗体工作正常;利用STX11抗体IP富集后检出SNAP25蛋白,SNAP25抗体IP富集后同样检出STX11蛋白,表明STX11与SNAP25存在相互作用。
2、蛋白修饰研究

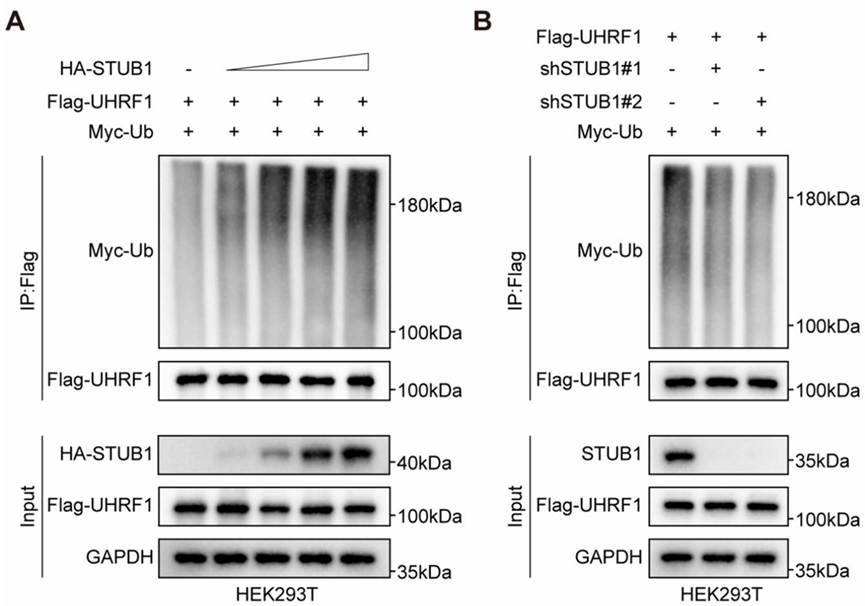
利用Co-IP检测泛素E3连接酶STUB1对UHRF1的泛素化修饰作用。图A中,Input结果显示GAPDH和Flag-UHRF1表达正常,HA-STUB1随加入量表达逐渐升高;IP:Flag结果显示,利用Flag抗体进行IP富集后,Flag-UHRF1正常检出,表明IP富集正常,Myc-Ub检出,且条带随STUB1加入量增加而逐渐升高,表明UHRF1与E3连接酶SUTB1相互作用被泛素化修饰。图B中,干扰STUB1的表达,导致IP:Flag组中Myc-Ub条带减弱,表明STUB1的敲低抑制UHRF1的泛素化修饰。PS:Myc-Ub是泛素分子,在进行泛素化修饰实验中提供所需的泛素分子。
3、筛选疾病标志物

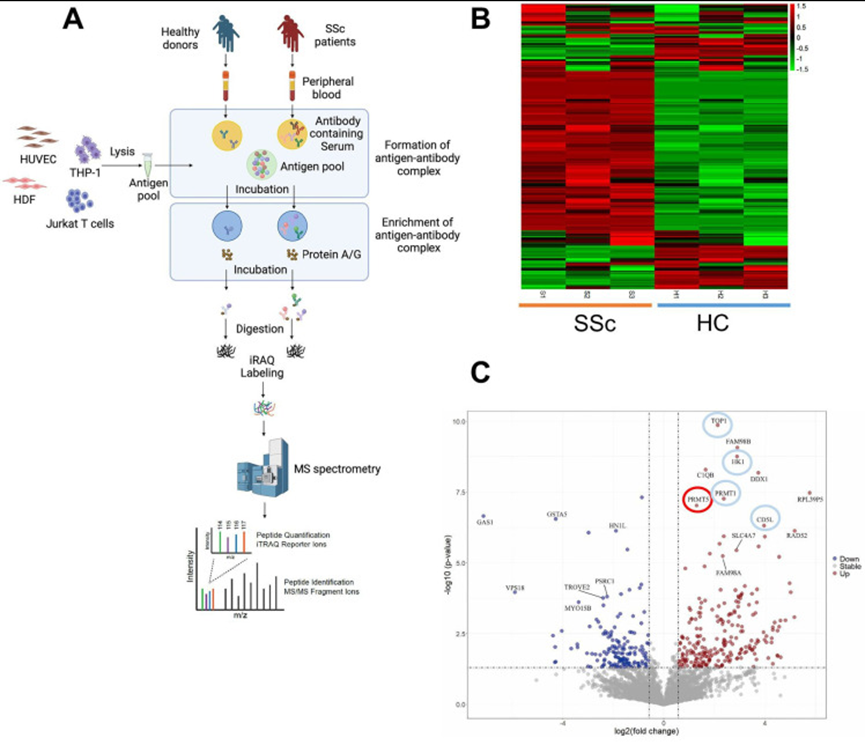
研究人员通过使用源自细胞裂解物的抗原库,对系统性硬化症(SSc)患者或健康供体的血清利用磁珠进行IP富集。富集的抗原-抗体复合物进行质谱(MS)分析鉴定,并对候选差异抗体在两组独立的SSc患者中进行正交验证,结果显示显示SSc患者的抗PRMT5抗体显著升高。并且候选差异抗体在区分SSc与健康对照和其他自身免疫性疾病(包括系统性红斑狼疮和干燥综合征)方面表现出强大的诊断准确性,曲线下面积范围为0.900至0.988。结合分子生物学实验最终证实抗PRMT5抗体在SSc中的潜在关键作用。
4、筛选下游互作蛋白或药物靶点

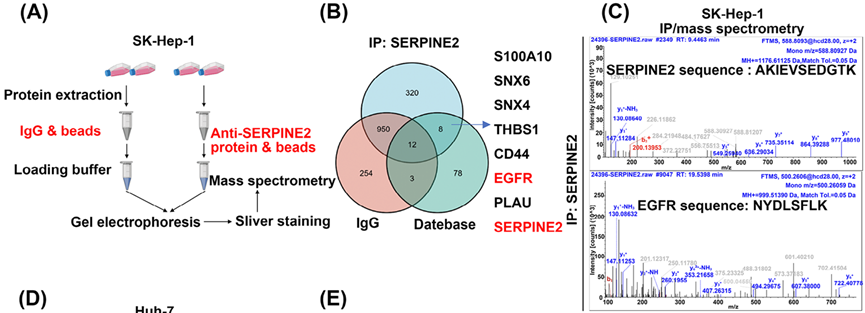
为了鉴定SERPINE2相关蛋白并探索SERPINE2在肝癌转移中的潜在分子机制,研究人员利用SERPINE2抗体进行IP富集后,以IgG抗体作为阴性对照,通过质谱分析与SERPINE2存在互作的潜在蛋白,并结合STRING数据库的数据确定了7种潜在的SERPINE2相互作用蛋白,并通过Co-IP证实SERPINE2与EGFR存在相互作用。厦门普睿迈格生物科技有限公司提供各类磁珠http://www.purimagbead.com/Product/,用于化学生物学研究。
- 上一篇:蛋白互作检测之磁珠法Pull-down技术精解 2025/5/18
- 下一篇:基于纳米颗粒的血浆蛋白质组学中血液成分污染的系统性评估 2025/5/17

