蛋白互作检测之磁珠法Pull-down技术精解
1988年,澳大利亚两位科学家Donald B. Smith和Kevin S. Johnson首次提出谷胱甘肽S-转移酶(Glutathione S-Transferase, GST)亲和标签的概念,并成功从细菌中一步纯化出高纯度GST融合蛋白。此后,目的蛋白融合GST标签后进行亲和纯化被广泛使用,至今仍是纯化重组蛋白常用的方法,由此衍生的GST Pull-down技术同样是蛋白互作研究重要手段之一。
一. Pull-down技术原理
Pull-down是指利用生物素、His或者GST等标签与已知蛋白融合表达作为诱饵蛋白,随后将诱饵蛋白纯化或固定在与其亲和的固相支持物上(磁珠),与蛋白样本或者包含蛋白样本的裂解液共孵育,进而捕获能够与诱饵蛋白相互作用的蛋白质,最终通过洗涤、洗脱、WB检测或者质谱分析等手段获得与诱饵蛋白存在相互作用的蛋白的一种方法。按照标签类型可分为GST Pull-down、His Pull-down、生物素-Pull-down等。
GST Pull-down技术即是基于Pull-down的原理,将已知蛋白与GST标签融合表达纯化并固定在含谷胱甘肽(GSH)的琼脂糖珠上(磁珠购买请参考http://www.purimagbead.com/Product/3249714524.html),形成已知蛋白-GST-GSH-琼脂糖珠复合体,随后与蛋白样本共孵育,捕获与已知蛋白相互作用蛋白并进行Western blot检测或者质谱鉴定。
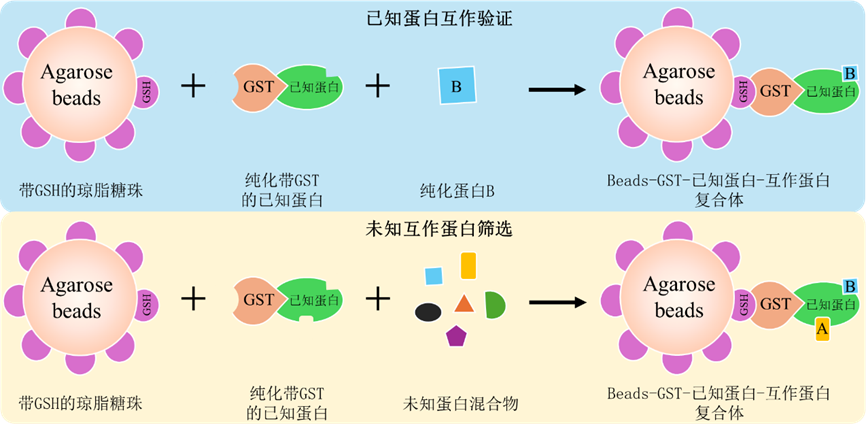
图GST Pull-down原理示意图
二. Pull-down技术特点
1、技术优势
-
直接验证蛋白相互作用,证据扎实;
-
蛋白标签与固相支持物亲和力强,洗脱纯度高;
-
无需抗体,亲和作用结合,富集效果好;
2、技术缺陷
-
需将蛋白通过原核表达系统纯化出来,增加实验难度;
-
体外验证互作,无法反映体内真实互作状态;
-
无法检测间接相互作用或者弱相互作用;
-
部分标签较大,可能影响蛋白构象,造成假阴性;
-
蛋白可能因强电荷作用结合,造成假阳性;
三. Pull-down常用标签
通常能用于蛋白纯化的标签都可用于Pull-down实验,一般常用蛋白纯化标签如GST、His、MBP、SUMO以及生物素等,具体特点如下:
(1)GST标签:大小为26 kDa,使用GSH亲和纯化,广泛应用于各种融合蛋 白表达,能够形成高度可溶的蛋白,且在大肠杆菌中能够大量表达,但分子量较大,可能影响蛋白构象;
(2)His标签:大小为0.84 kDa,使用Ni柱纯化,在非离子型表面活性剂存在 或者变性条件下纯化,能够纯化包涵体蛋白,纯化条件相对温和;
(3)Flag标签:大小1.01 kDa,可直接通过FLAG亲和层析进行非变性纯化, 纯化效率高,并且在真核表达系统中效率高;
(4)MBP标签:大小为40 kDa,全称为麦芽糖结合蛋白标签,使用MBP结合 基质(丙糖醛酸琼脂糖树脂,amylose resin)进行纯化,能够减少目的蛋白降解,增加蛋白表达量和稳定性,MBP序列N端含有信号肽,适用于毒性蛋白纯化,但标签较大,可能影响目的蛋白空间构象;
(5)SUMO标签:大小11.5 kDa,是小分子泛素相关修饰蛋白,能够促进蛋白正确折叠,并且具有耐热和耐蛋白酶特性,能够保持纯化蛋白的稳定性;
(6)NusA标签:大小为54.9 kDa,不具备独立的纯化标签,需与His等标签联用后亲和纯化,能够极大提高蛋白可溶性,但可能影响蛋白空间构象;
(7)生物素(Strep)标签:大小为1.06 kDa,可用生物素亲和纯化,偏好真核表达系统,目的蛋白纯度高;
四. Pull-down技术流程
1、融合蛋白小量表达测试(以GST Pull-down为例)
(1)选择GST纯化标签和适当表达载体并构建GST-蛋白A表达质粒;
(2)将表达质粒转化至宿主细胞如大肠杆菌BL21中,培养至适当密度(OD = 0.6-0.8)后,加入异丙基硫代半乳糖苷(IPTG)进行蛋白表达诱导;
注意:IPTG浓度一般设置在0.3-1.0 mM之间;IPTG诱导温度通常设置常温(28 ℃)和低温(16 ℃)两组;IPTG诱导时间设置4-18 h之间;
(3)分别设置不同IPTG使用浓度、培养温度以及培养时间进行蛋白表达诱导;
(4)蛋白表达诱导完成后,分别收集不同条件下诱导培养的菌体,加入PBS后超声破碎,收集上清;
(5)加入Loading Buffer煮样后Western blot检测GST-蛋白A表达效果;
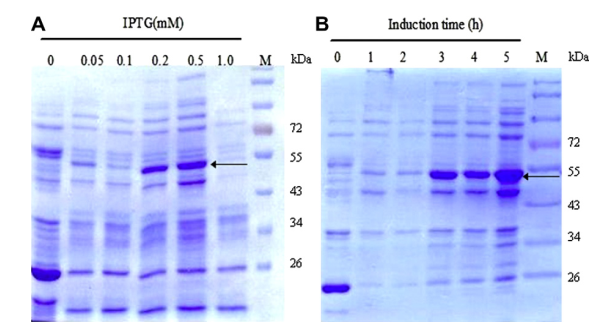
图 蛋白表达结果示意图(图片来源于网络)
2、蛋白大量表达纯化
(1)根据小量表达测试结果,选择最适宜的IPTG使用浓度、诱导温度和时间,进行GST-蛋白A大量表达诱导;
(2)诱导结束后,收集菌体加入PBS后进行超声破碎,收集上清;
(3)使用GST纯化柱对到蛋白进行纯化获得GST-蛋白A;
(4)取适量纯化后的蛋白,进行考马斯亮蓝染色检测蛋白纯度和浓度;
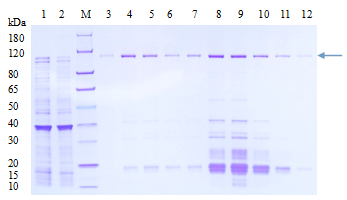
图 蛋白纯化结果示意图(图片来源于网络)
3、Pull-down实验
若互作蛋白B同样通过蛋白表达纯化,可直接按照步骤(4)进行Pull-down实验;若互作蛋白B未通过蛋白表达纯化或互作蛋白未知,则需按照步骤(1)-(3)准备互作蛋白样本。
(1)培养并处理细胞(质粒转染、药物处理等);
(2)选择适当细胞裂解液(含蛋白酶抑制剂、磷酸酶抑制剂)对细胞进行裂解;
(3)离心,去除细胞碎片,收集上清;
(4)将制备好的GST-蛋白A固定到GSH-琼脂糖磁珠上(磁珠购买请参考http://www.purimagbead.com/Product/3249714524.html),形成beads-GSH-GST-蛋白A复合体;
(5)将蛋白B或者细胞裂解液与beads-GSH-GST-蛋白A复合体共孵育,形成beads-GSH-GST-蛋白A-蛋白B复合体;
注意:通常设置beads-琼脂糖磁珠与裂解液共孵育作为阴性对照组;
(6)洗涤去除非特异性结合蛋白;
(7)利用洗脱缓冲液洗脱目的蛋白并收集目的蛋白;
(8)Western blot检测已知蛋白B或者质谱分析未知蛋白;
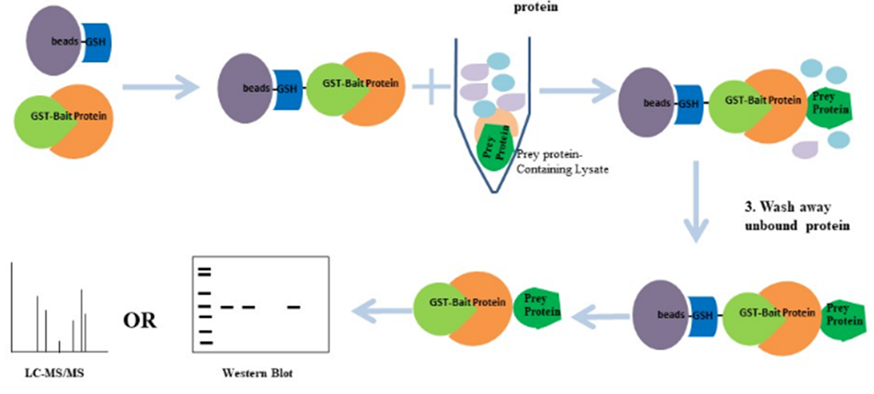
图 GST Pull-down实验流程示意图
六. Pull-down结果解读1、已知蛋白互作验证
对于已知蛋白是否存在相互作用,通常利用Western blot进行检测,设置GST+His-B组作为阴性对照;Input用于蛋白表达检测,Pull-down分析互作结果分析。
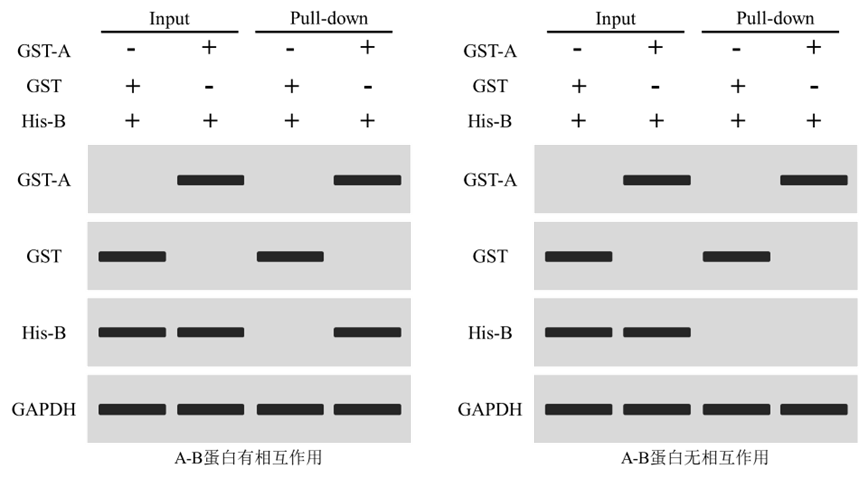
上图为检测蛋白A和蛋白B是否互作结果。结果显示,Input和Pull-down中,GAPDH皆正常检出,表明细胞样本蛋白提取正常(若蛋白B也为纯化蛋白,则无需检测GAPDH表达);Input和Pull-down中,GST+His-B组中仅检出GST目的条带,GST-A+His-B组中仅检出GST-A目的条带,表明GST-A蛋白纯化正常且无非特异性条带;
左图中,Input正常检出His-B目的条带,表明蛋白B表达正常;Pull-down中GST+His-B组未检出条带,表明GST不与His-B发生结合;GST-A+His-B组检出His-B蛋白,表明GST-A可富集His-B,蛋白A和蛋白B存在互作;右图中,GST-A+His-B组未检出His-B蛋白,表明GST-A无法富集His-B,蛋白A和蛋白B不存在相互作用。
2、未知互作蛋白筛选
对于筛选与目的蛋白存在相互作用的潜在蛋白,通常利用质谱技术进行分析。首先利用Western blot技术对Pull down结果进行检测,Western blot检测包含Input组、GST组以及Pull-down组,其中Input组和GST组分别作为阳性对照和阴性对照,Pull-down则用于检测GST-A是否正常存在;质谱分析时可将GST样本作为阴性对照,排除假阳性信号。
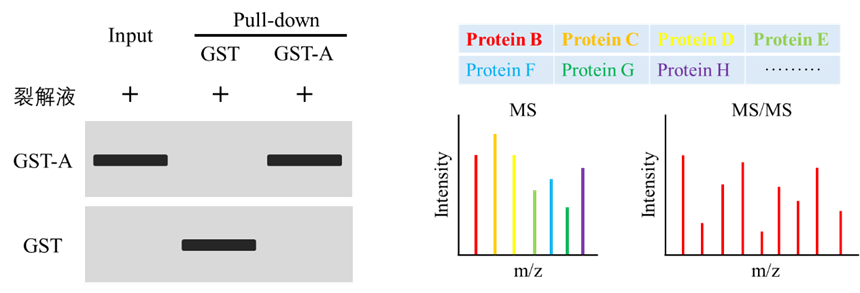
七. Pull-down影响因素
在Pull-down实验过程中,蛋白表达、纯化、Pull-down实验各个过程出现问题都会影响最终Pull-down结果,主要影响因素如下:
1、融合蛋白标签选择
不同蛋白标签大小差别较大,部分大分子量标签如GST、MBP以及NusA等可能会影响蛋白的正确折叠或者蛋白表达,因此可在实验前利用生物信息学预测标签是否影响蛋白构象或者采用X-射线晶体分析等手段加以验证,保证实验结果更加可信。
2、蛋白表达载体的选择
不同蛋白表达系统质粒载体对于融合蛋白可溶性、蛋白表达诱导方式以及表达丰度存在差异,因此在进行蛋白表达纯化时需选择合适的表达质粒,确保融合蛋白能够大量表达可溶性蛋白。例如pGEX载体通常用于GST融合蛋白表达。目前常用蛋白表达载体如下:
(1)pET系列:T7启动子,使用His标签,便于蛋白纯化,并且蛋白表达量 高,但容易形成包涵体;
(2)pGEX系列:Tac启动子,使用GST标签,表达量高,促溶效果好,是目 前使用较为广泛的表达载体,但GST标签较大,可能影响蛋白构象;
(3)pMAL系列:Tac启动子,使用MBP标签,促溶效果极强,但MBP标签 大,容易影响蛋白构象;
(4)pCold系列:CSPA启动子,带有低温诱导原件,通常适用于温度敏感蛋 白,蛋白表达量较低。
3、蛋白表达诱导条件
(1)诱导温度
由于蛋白间存在较强的温度依赖性疏水作用,温度过高导致蛋白聚集并沉淀,容易形成包涵体。因此大部分蛋白表达表达需低温诱导(16℃);但部分温度敏感型表达载体如pBV220则需要较高温度进行(30℃)蛋白表达诱导。因此在进行小量蛋白诱导表达时可设置高温组和低温度进行检测,选择适合的诱导温度。
(2)诱导时间
蛋白表达过程中,通常选择在菌体处于对数生长期(OD值一般为0.6-0.8)进行蛋白表达诱导。由于菌体此时生长速度快,因此可获得大量可溶性蛋白。通常而言,诱导时间与诱导温度成反比,诱导温度越高,诱导时间越短;若为低温诱导,则需相应延长表达诱导时间。在进行小量蛋白诱导表达时可设置不同诱导时间梯度,选择适合的蛋白高表达诱导时间。
(3)诱导剂浓度
不同的蛋白表达载体需选择不同诱导剂。以GST Pull-down实验为例,目前常用表达载体为pGEX系列,所用诱导剂为IPTG。虽然IPTG不会被细菌代谢而保持稳定的浓度,但由于具有一定的细胞毒性,因此浓度过高会导致菌体活性差甚至死亡,进而影响蛋白表达和纯化,例如产生大量错误折叠蛋白并形成包涵体。因此在实验中通常设置不同浓度梯度,并且尽量选择低浓度、长时间诱导表达的方式,以获取足够量的可溶性融合蛋白。常用蛋白表达诱导剂如下:
-
IPTG(异丙基硫代-β-D-半乳糖苷):最常用的诱导剂之一,通常用于大肠杆菌表达系统,主要通过与lac操纵子结合,解除阻遏蛋白对启动子的抑制,启动目的蛋白表达。
-
乳糖/乳糖类似物:与IPTG类似,在天然的lac系统中,乳糖或者其类似物可以通过与lac操纵子结合诱导目的基因表达。此类诱导剂通常适用于更加温和或者更加自然条件下的蛋白表达。
-
抗生素:针对特定系统并选择特定抗生素,如Tet-on/Tet-off系统选择四环素或其衍生物,能够通过与相应调控元件结合诱导目的基因表达,此类诱导剂通过特定浓度抗生素启动或者关闭蛋白表达。
-
金属离子:与抗生素诱导类似,某些金属相应的表达系统中,如T7噬菌体启动子系统结合金属离子(Zn2+)能够诱导目的蛋白的表达,此类诱导剂使用浓度需根据载体和细胞系的敏感性进行确定。
4、包涵体形成
在蛋白表达过程中,由于蛋白错误折叠并聚集形成包涵体时,导致Pull-down实验失败。可通过使用高浓度的尿酸和盐酸胍使其变性解聚,随后逐步去除变性剂并加入适当的缓冲液使蛋白重新折叠,恢复功能性构象,进行后续的pull-down实验。也可通过降低诱导温度及诱导剂浓度、引入分子伴侣共表达、换专用感受态等方式来解决。
5、核酸分子影响
对于RNA结合蛋白或者DNA结合蛋白,在存在核酸的情况下,会通过与核酸结合造成假阳性,因此在进行Pull-down实验时需要加入核酸酶,去除核酸造成的假阳性结果。
八. Pull-down常见问题
1、Pull-down结果出现背景信号
背景杂带信号主要源于非特异性结合。在GST-A富集靶蛋白阶段可通过增加洗脱次数、更强的洗脱条件、使用BSA等抑制非特异性结合过程;在Western blot实验时,则需严格按照实验流程,参考前文《蛋白互作检测之磁珠法Co-IP技术》,使用更加合适的抗体等方法减少非特异性结合。
2、Pull-down蛋白条带模糊
出现蛋白条带模糊的原因包括蛋白纯度不够或者蛋白降解导致。针对前者可适当增加蛋白洗脱过程中洗脱剂的浓度或者优化蛋白纯化方法如在Ni亲和层析时使用高盐buffer;更换表达菌体,进行蛋白标签联用等手段解决蛋白纯度不够问题;针对蛋白降解问题,如是因为蛋白序列或者密码子偏好性等原因,则可换用Rosett、OrigamiB等菌体进行蛋白表达。此外可在实验中增加蛋白酶抑制剂的用量,保证实验全程低温进行等。
3、Pull-down结果与其他手段结果不一致
由于Pull-down实验属于体外水平,仅能验证直接相互作用,因此对于某些间接互作蛋白无法有效检出,而Co-IP技术用于检测体内生理状态下蛋白互作情况,可检出间接互作蛋白。因此Pull-down结果可能存在与其他检测结果不一致的情况,此时需增加检测手段,进行相互佐证并分析具体互作类型。
九. Pull-down技术案例
1、GST Pull-down证实PHB2调控SHIP2与PHB1和PHB2的互作

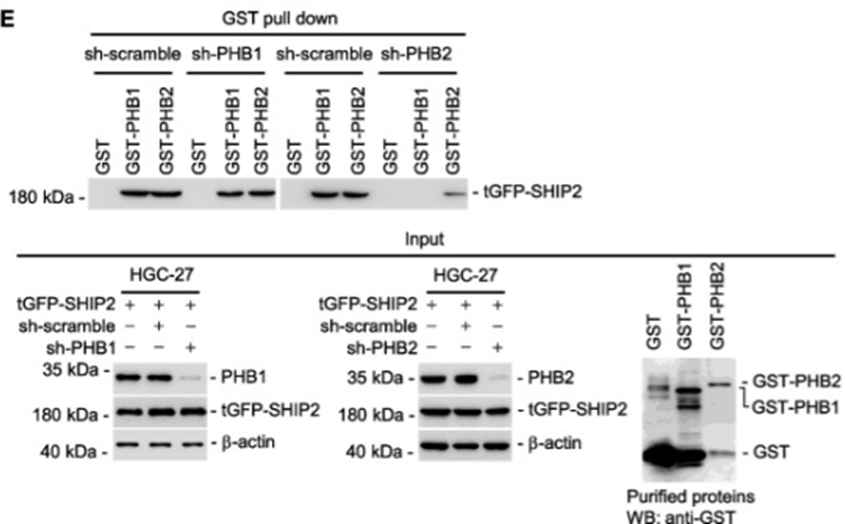
上图Input结果显示,内参蛋白β-actin表达正常,tGFP-SHIP2表达正常,GST-PHB1和GST-PHB2表达正常;GST Pull-down结果显示,使用GST-PHB1或者GST-PHB2蛋白均可拉下t-GFP-SHIP2,表明SHIP2蛋白与PHB1或者PHB2均存在相互作用。使用sh-PHB1干扰PHB1的表达,对GST Pull-down结果无影响,使用shPHB2干扰PHB2的表达时,GST-PHB1与tGFP-SHIP2的互作消失,GST-PHB2与tGFP-SHIP2的互作减弱,表明SHIP2与PHB1或者PHB2的互作依赖于PHB2的表达。
2、蛋白直接相互作用研究

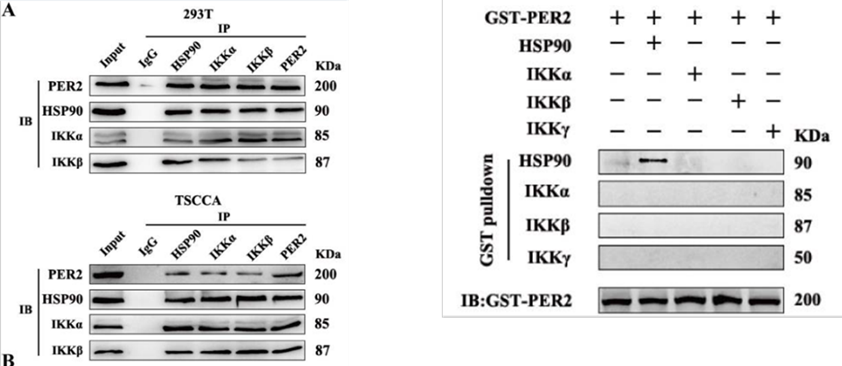
上图中,Co-IP结果显示(左图),在293T和TSCCA细胞中,利用PER2进行IP富集后,可检测到HSP90、IKKα、IKKβ目的蛋白,表明PER2蛋白与HSP90、IKKα、IKKβ蛋白形成复合体;GST Pull-down结果显示(右图),使用GST-PER2进行富集后,金科检测到HSP90目的蛋白,表明PER2仅与HSP90为直接互作,与IKKα、IKKβ蛋白为间接互作。
- 上一篇:生物分离新趋势:通过磁分离强化下游加工 2025/5/30
- 下一篇:蛋白互作检测之磁珠法Co-IP技术 2025/5/18

