2020年独立医学检验实验室(ICL)行业发展概况及第三方检测行业发展趋势分析
一、中国独立医学检验实验室(ICL)行业发展概况
1、独立医学检验实验室(ICL)是新冠病毒检测主力军
中国的独立医学实验室细则在2009年发布,从2009年后,整个产业高速增长。近几年分级诊疗政策持续推进,行业增长依然得以保持高增速。然而随着分级诊疗的推进,政策对第三方实验室的增长呈现双刃剑模式。独立医学实验室的增长会经历先提升再放缓的过程,预计到2018或者2019年出现明显放缓。在近几年中,随着门诊量的持续流入基层医疗机构,基层医院对于一些高端项目的需求增加,比如化学发光和分子诊断检测,对于独立医学实验室依赖程度加强。然而随着高端检测设备的国产化进程发展,性能提升,成本下降,基层医疗硬件和软件实力都在不断提升,一些发光项目、甚至分子项目可以自行检测,甚至一些曾经只能在大三甲检测的项目,随着便捷的商业化产品的出现,可以在基层进行检测,对于项目外送动力减弱,独立医学实验室的增速放缓。
近年来,国家大力扶持第三方服务中心,如第三方医学检验实验室、第三方影像等服务中心,鼓励社会资本流入,共建实验室。然而整个行业的模式仍然处于摸索状态,主要可分为区域检验中心和点状的大型检验中心,两种模式在激烈交错中竞争。行业在迅速增长的过程中,呈现一些特点和趋势。
|
1
|
政府介入独立医学实验室的建设,行业呈非市场化状态。
|
-
|
|
2
|
检验互认的需求提升,非门急诊检测数量下降,尤其是高端项目的检测
|
由于非门急诊项目对时效性要求不高,其检测价格又相对较高,互认的需求在现阶段主要针对该类项目。随着检验结果互认政策的推进,高端项目整体检测量会下降。
|
|
3
|
国产设备的崛起,基层医疗机构自测能力具备了提升的硬件条件
|
由于中国与美国的医院结构、商业保险发展阶段、居住模式有较大的差异,第三方实验室的发展会走出一条有中国特点的路径。行业会在短期内保持较高的增长速度,行业龙头会持续享受行业增长红利。
|
中央部署扩大重点地区核酸检测和血清抗体检测范围。中央应对新冠肺炎疫情工作领导小组16日召开会议。会议指出,当前我国疫情防控任务仍然艰巨,境外输入和个别地方本地疫情交织叠加,不能掉以轻心。各地要增强紧迫感,加快提高核酸和抗体检测能力,扩大检测范围,做好对重点地区重点人群应检尽检工作。
中央部署提高检测能力做好对重点地区重点人群应检尽检工作
|
-
|
工作重点
|
具体实施
|
|
全国
|
境外输入和个别地方本地疫情交织叠加,加快提高核酸和抗体检测能力
|
扩大检测范围,做好对重点地区重点人群应检尽检工作。要做好社区和公共场所常态化科学精准防控,落实“筛查—诊断—报告—隔离”闭环管理要求,一旦发现疫情立即精准围堵。
|
|
边境
|
根据疫情跨境输入形势变化,突出重点做好防控
|
边境省份要有针对性完善防控方案,一市一策,分片包干,落实责任,加强边境地区防控薄弱环节;加大疫情防控人员和物资等保障力度,切实做好检疫检测、隔离观察点、方舱医院、定点救治医院等应急准备
|
无症状感染患者的筛查隔离是阻断疫情的重要途径。国务院印发的《新冠病毒无症状感染者管理规范》指出“新冠肺炎无症状感染者具有传染性,存在着传播风险”。这类患者有较强免疫能力,在感染病毒后14天内不发病,无临床症状,为疫情防控带来挑战。从4月9日至15日哈尔滨1传37感染路径来看,无症状感染者是传染链条上的关键一环,因此对无症状感染者检测、筛查、隔离为防疫的重要措施。
国内无症状感染患者相关情况梳理
|
无症状感染者
|
具体情况
|
|
患者特点
|
通常无症状感染者自身免疫力比较强,只有少部分人会转为确诊病例。只有1/5的无症状感染者可能转为确诊病例,其他患者一直保持无症状状态。
|
|
传染力
|
平均每个无症状感染者传播不到1人,无症状感染者传染力相当于确诊病例的1/3;但是病毒具有无规律性,个别病患传染能力无规律
|
|
患者来源
|
一是确诊患者的密切接触者,二是来自疫情重点地区
|
|
排查城市
|
北京、辽宁、上海、江苏、浙江、湖北、广东、四川、重庆全国9省市及武汉市
|
|
筛查方式
|
核酸、IgG、IgM抗体检测
|
|
应对措施
|
24小时内要完成无症状感染者的个案流行病学调查,尽早发现其密切接触者,对两者进行14天的集中隔离医学观察;14天隔离期满后,要经过两次核酸检测,阴性的才能解除集中隔离医学观察。解除后还要求这些无症状感染者继续进行14天的医学观察,并进行随访,对无症状感染者采取严格的医学管控措施
|
可进行核酸诊断的生物安全二级(BSL-2或P2)及以上实验室资源相对稀缺。我国根据所处理的病原微生物及其毒素的危害程度将生物安全实验室分为四级,其中二级实验室可以从事一些致病性较强的生物因子的实验活动,且建设和使用要求较生物安全三级实验室低。中国大陆目前共有1个P4实验室,即武汉P4病毒实验室;另有约68个P3实验室,根据2014年全国22省调查反馈共有负压BSL-2实验室358套,其中投入使用的占95.81%(343/358),尚未使用的占4.18%(15/358),未投入使用的主要是一些区县级疾控中心的实验室,样本调查的负压BSL-2实验室资源相对短缺。
中国生物安全实验室数量
|
级别
|
全国数量
|
用途
|
|
P4
|
1
|
适用于研究在人类可以引起严重或致死的疾病,但通常无预防和治疗方法,如炭疽杆菌,霍乱弧菌等;对人体具有高度的危险性,通过汽溶胶途径传播或传播途径不明、目前无有效疫苗或治疗方法的致病微生物或其毒素
|
|
P3
|
68
|
适用于研究在人类可以引起严重或致死疾病的,而且可能有预防和治疗方法微生物;用于主要通过呼吸途径使人传染上严重的甚至是致死疾病的致病微生物或其毒素
|
|
P2
|
358
|
适用于研究在人类所引起的疾病很少是严重的,而且通常有预防及治疗方法的微生物;对人和环境有中等潜在危害
|
|
P
|
1-
|
适合研究与人类成人健康和疾病无关的微生物;对健康成人无致病作用
|
国务院首次提出独立委托医学检验实验室分担新冠病毒检测任务。4月18日,国务院发文明确独立医学实验室在新冠病毒检测中的参与方式。其中,涉及到独立医学实验室的内容,由以往的“鼓励”转变为“应当由”,并首次提出“委托给独立设置的医学检验实验室”。
中国独立医学实验室的抗疫参与模式
|
模式
|
具体情况
|
|
与官方授权机构共建实验室
|
ICL可与官方授权机构共建实验室,扩大定点机构检测实力;迪安诊断已经帮助很多县域建立了新冠病毒筛查的PCR实验室,为县域提供一体化服务
|
|
提供技术人才与耗材设备
|
ICL行业富集检验技术人才,与ICD上下游资源,可以多样化提供定点机构检测支持,如金域医学、华大基因等
|
|
冷链物流
|
基于ICL行业的生物样本冷链物流系统,建立物资及样本流通渠道
|
|
快速反应实验室
|
为快速大幅提升检测能力,华大基因通过5天时间的高效施工建设,日检测能力达万人份的武汉“火眼”实验室即可完成运行
|
|
官方授权实验室
|
官方授权的ICL检测机构,现有实验室符合检测标准;截止3月19日,各地已授权的独立医学实验室所属的公司共有60家,其中全国连锁性的独立医学实验室有11家,覆盖全国26个省及直辖市,合计已授权独立医学实验室共141家,如金域医学
|
2、我国独立医学实验室在业数量及分布情况
伴随老龄化、城镇化等社会经济转型,居民健康需求增长迅速,但是优质医疗资源主要集中在大城市大医院,基层医疗机构医疗资源相对缺乏。三甲医院一直承担着超负荷的医学检测业务,基层医疗机构则受限于资金、人才、样本量等因素,无能力开展相关高技术、创新的检测项目。
得益于重新合理配置医疗资源的新医改要求,再加上检验技术的高速革新,我国独立医学检验室数量快速增长,特别是近年尤为显着。智研咨询发布的《2020-2026年中国独立医学实验室市场研究及投资前景预测报告》显示:2012年全国的独立医学检验试验室才129家,2015年快速增加至400家,2019年我国独立医学实验室暴增到1537家。
2012-2019年我国独立医学实验室在业数量情况
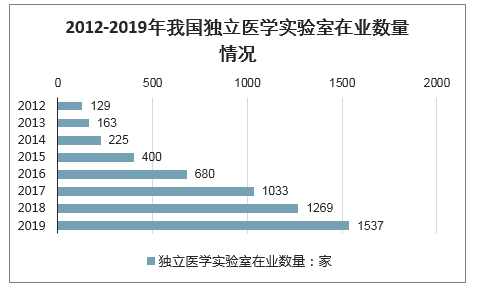
数据来源:公开资料整理
从区域分布来看,独立医学实验室主要分布在经济较发达的沿海地区,如广东、江苏、浙江、山东、北京等地区。
我国主要省市独立医学实验室分布数量(家)
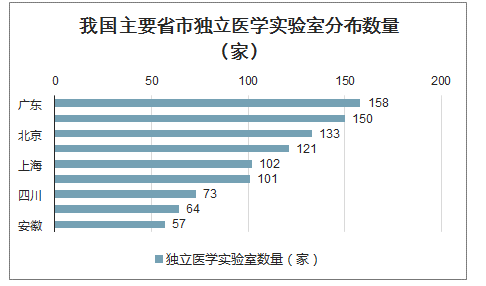
数据来源:公开资料整理
国家卫健委要求三级综合医院都要具备独立开展新冠病毒检测能力。国家卫健委提出三级综合医院均应当建立符合生物安全二级及以上标准的临床检验实验室,具备独立开展新型冠状病毒检测的能力;各级疾控机构和有条件的专科医院、二级医院、独立设置的医学检验实验室也应当加强实验室建设,提高检测能力。从各省公立三级医院与独立医学检验实验室分布情况来看,独立医学检验实验室可以与公立医院共同承担检测新冠病毒的任务。
中国各省地区公立三级医院与独立医学检验实验室分布情况
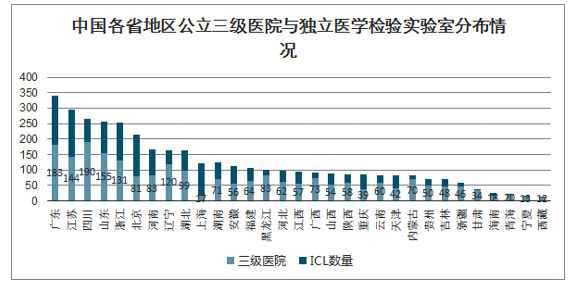
数据来源:公开资料整理
3、新冠病毒爆发期间ICL检测服务市场情况分析
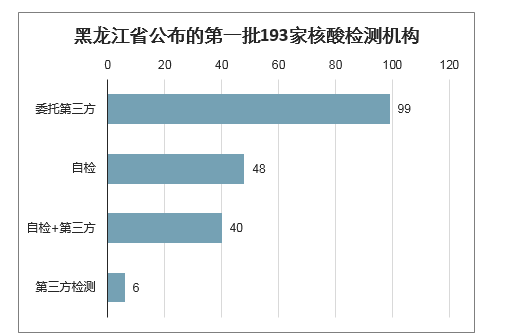
参照武汉、黑龙江地区的检测情况来看,估计ICL检测量与公立医疗机构检测量的比例约为3:1至4:1。从黑龙江地区的检验政策来看,第三方检验发挥重要作用。黑龙江省卫健委公布总计193家核酸检测机构名单,其中仅有48家医院可进行核酸自检,其余145家医疗机构分别采取自检+委托第三方、完全委托第三方检验的方式进行新冠病毒的检测,第三方检测机构数量与公立医院数量比例为3:1。在疫情期间,武汉地区的新冠病毒检测中,ICL检测量约为80%,公立医院检测量约为20%。
武汉地区新冠病毒检测量情况
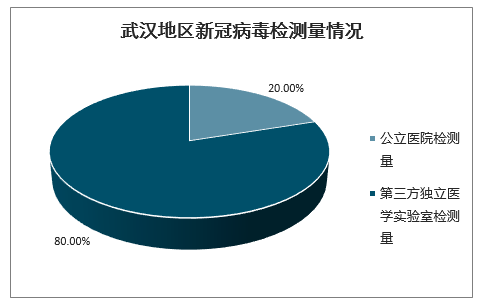
数据来源:公开资料整理
黑龙江省公布的第一批193家核酸检测机构
数据来源:公开资料整理
全国多地进行价格规范,湖北地区通过集采降价大幅压缩检测试剂盒采购成本。由于新冠病毒检测具有更多的社会意义,全国各地逐渐进行规范核酸检测价格,其中,湖北进行集中采购“砍价”。核酸检测试剂盒的采购单价为16.78-24.99元/盒,检测服务最高限价为180元/人次,抗体检测试剂盒采购单价为12.90-13.89元/盒,检测服务最高限价为50元/人次
湖北集采后的采购与检测服务价格
|
试剂盒类型
|
生产企业
|
试剂盒单价(元/盒)
|
检测服务最高限价(元/人次)
|
|
核酸检测
|
迈克生物
|
16.78
|
180
|
|
达安基因
|
20
|
||
|
明德生物
|
23.9
|
||
|
华大基因
|
24.99
|
||
|
抗体检测
|
丽珠集团
|
12.9
|
50
|
|
南京诺唯赞
|
13.89
|
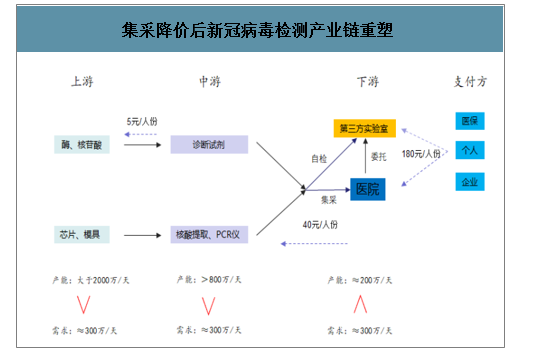
集采降价后的新冠病毒检测产业链格局重塑。通过分析新冠病毒检测产业链来看,检测的上游原料、元器件,中游检测试剂、检测设备的产能远大于需求量,可以满足市场的需求,下游公立医疗机构、第三方检验(ICL)累计可供应的检测能力需要持续扩大以满足防疫需求。湖北地区针对检测试剂盒进行集采降价后,上游、中游企业利润下滑,相比来看,检测服务最高限价给下游检验服务留有充足的价格空间。
集采降价后新冠病毒检测产业链重塑
数据来源:公开资料整理
下游检验服务依然保有较高利润空间。第三方检测机构的核酸检测试剂采购价约为27-60元/人份,抗体检测试剂采购价约为10-30元/人份,集采后,核酸检测采购最高价为25元/人份,抗体检测采购最高价为13.9元/人份,集中采购后,核酸检测的利润可达到约155元/人份
集采降价后新冠病毒检测服务保留较高利润空间
|
全国检测试剂盒采购单价范围(元/人份)
|
|
|
核酸检测:17-60
|
抗体检测:10-30
|
|
医院及第三方利润估算=检验收费-试剂成本
|
|
|
集中采购前
|
190=260-70
|
|
集中采购后
|
155=180-25
|
新冠病毒作为医院常规检测项目,全国检测量估计为2763万人份/月,估计ICL检测服务市场规模可达38.68亿元/月。2019年1-10月,全国医疗卫生机构出院人数达21074.3万人,折合每月2107.4万人;国家卫健委披露,全国31个省份共设置发热门诊1.5万个,定点医院2092家。4月3日,全国医疗机构发热门诊共接诊22.1万人次,根据以上数据假设全国月度住院病人数量为2100人次,月度发热门诊就诊人数为663万人次,估计全国月度新冠病毒检测量达2763万人份,月度采购市场规模约6.91亿元,月度检测服务市场规模为49.73亿元,其中ICL检测服务的月度市场规模可达38.68亿元。
新冠病毒作为常规检测项目的全国检测量估计
|
指标
|
数值
|
|
住院病人(万人/月)
|
2100
|
|
定点发热医院(家)
|
2092
|
|
发热门诊就诊人数(万人/月)
|
663
|
|
合计所需检测人群数量(万人/月)
|
2763
|
|
检测试剂盒出厂均价(元/盒,参考湖北)
|
25
|
|
月度检测试剂盒采购市场规模(亿元)
|
6.91
|
|
检测服务最高限价(元/人次,参考湖北)
|
180
|
|
月度检测服务市场规模(亿元)
|
49.73
|
|
公立医院(亿元)
|
11.05
|
|
第三方独立医学检验实验室ICL(亿元)
|
38.68
|
|
月度累计市场规模(亿元)
|
56.64
|
(注:合计所需检测人群数量=住院病人+发热门诊就诊人数月度累计市场规模=月度检测试剂盒采购市场规模+月度检测服务市场规模月度检测服务市场规模=公立医院+第三方独立医学检验实验室ICL(假设ICL检测量:公立医院检测量=3.5:1))
4、第三方检验行业市占率
国内第三方检验行业的四大龙头企业市占率达到70%。中国第三方检测行业起步较晚,国内约95%的检验业务由医院检验科完成,第三方检验的渗透率不足5%,其中迪安诊断、金域检验、艾迪康、达安基因四家龙头企业的规模市占率约70%,且随着国内第三方检验行业的市场良好发展势头,龙头企业持续加速全国布局。
中国四家ICL基本情况梳理
|
-
|
广州金域医学
|
杭州迪安诊断
|
杭州艾迪康
|
广州达安基因
|
|
实验室数量
|
37
|
38
|
17
|
8
|
|
覆盖医院数
|
16000+
|
3000+
|
3000+
|
1000+
|
|
检验项目数
|
约2500
|
2000+
|
1400+
|
1000+
|
|
商业模式
|
服务
|
服务+产品
|
服务
|
服务+产品
|
|
质量控制
|
CAP,ISO15189
|
CAP,ISO15189
|
CAP,ISO15189
|
CAP,ISO15189
|
|
检测标本量
|
约5000万/年(2017)
|
超10万个/天
|
约10万人/天
|
-
|
|
战略合作
|
与罗氏、梅里埃、西门子、雅培等公司形成战略合作,并成为罗氏及梅里埃中国大陆实验室示范基地
|
与罗氏、梅里埃、凯杰、韩国SCL、约翰霍普金斯医学院、日本滨松战略合作,成为罗氏中国示范实验室
|
与罗氏、西门子、日本SRL、梅里埃等战略合作,成为氏和西门子中国区示范实验室
|
与DAKO战略合作,与Life合作
|
|
新冠病毒检测通量(万人/天)10
|
-
|
-
|
-
|
-
|
|
累计检测量(万人份)
|
>300
|
>150
|
-
|
-
|
华大基因“火眼”实验室在海内外成功复制。“火眼”实验室为一体化的解决方案,不仅具备病毒核酸检测技术,还能够进行与核酸检测搭配使用的抗体检测和高通量测序。不但能够检测样本是否感染病毒,而且可以有效进行病毒溯源和病毒监测。疫情期间,公司陆续在武汉、深圳、天津等国内多个主要城市
布局“火眼”实验室并承接样本检测工作,截至4月24日,国内已建成10个以上眼实验室,国内检测通量可达到6万例/天,累计检测样本约71万例。为满足海外防疫需求,公司在全球范围内援建“火眼”实验室,已在国际累计启动73个火眼实验室,国际检测通量超过约22万例/天。
华大基因国内外“火眼”实验室情况(截至4月24日)
|
区域
|
火眼实验室数量
|
累计检测量(万例)
|
检测通量(万例)
|
|
国内
|
>10
|
~71
|
~6
|
|
国际
|
73
|
-
|
~22
|
三、全球检测能力需持续提升,检测试剂盒需求依然旺盛
1、海外累计所需检测试剂盒数量约1.25亿人份
截至4月29日,估计海外疫情全面有效控制的累计所需检测试剂盒数量约1.25亿人份,而实际累计检测人数约为3061万人次,检测能力供给缺口巨大。截至4月29日,海外179个国家新冠肺炎病毒累计感染人数达到314万人,假设实现疫情相对有效控制,检测覆盖率需达到约为20倍,累计所需的检测试剂盒数量约为6274万人份,累计检测阳性率可控制在5%;假设实现疫情全面有效控制,检测覆盖率需达到约为40倍,累计所需的检测试剂盒数量约为12548万人份。目前,海外88个国家累计检测人数约为3061万人次,实际检测覆盖率为10倍。
海外疫情相对可控与全面可控假设下所需检测试剂盒数量估算(截至2020年4月29日)
|
指标
|
数值
|
|
海外累计确诊人数(万人,统计值)
|
314
|
|
海外累计检测人数(万人,统计值)
|
3061
|
|
实际检测覆盖率(倍数)
|
10
|
|
相对有效控制
|
-
|
|
检测覆盖率(倍数)
|
20
|
|
累计所需检测试剂盒数量(万人份,估计值)
|
6274
|
|
全面有效控制
|
-
|
|
检测覆盖率(倍数)
|
40
|
|
累计所需检测试剂盒数量(万人份,估计值)
|
12548
|
(注:累计所需检测试剂盒数量=海外累计确诊人数*检测覆盖率相对有效控制检测覆盖率为20倍,全面有效控制检测覆盖率为40倍;海外累计确诊人数统计于全球179个国家,海外累计检测人数统计于全球主要疫情区的88个国家)
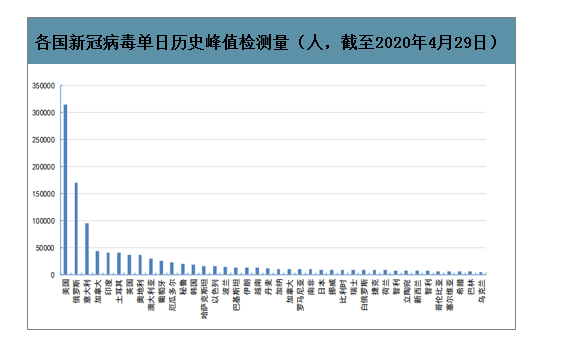
全球42个国家单日历史峰值检测量约为130万人份,全球检测能力需要持续提升。海外疫情从3月初开始加速爆发,截至4月29日,全球42个国家单日历史峰值检测量约为130.09万人份,其中美国约31.4万人份、俄罗斯约17.0万人份、意大利约9.5万人次,另有20个国家单日检测峰值大于1万人份。
(注:单日峰值检测量统计于单日检测峰值超过5000人份的42个国家,数据来自Ourworldindata)
各国新冠病毒单日历史峰值检测量(人,截至2020年4月29日)
数据来源:公开资料整理
以目前实际检测能力来看,累计检测量实现1.3亿人份约需100天。假设试剂盒均价为30-130元,全球42个国家单日历史峰值检测量合计约为130.09万人份,假设全球单日检测量为130万人份,疫情每延续一个月,检测增量为3900万人份,累计检测试剂盒市场销售额约20亿元人民币以上,估计百日检测量1.3亿人份,销售规模约65亿元人民币以上。
新冠病毒检测试剂盒全球销量弹性测试
|
全球销售额(亿元人民)
|
新冠肺炎病毒检测试剂盒单价(元人民币)
|
||||||
|
延续时间(天)
|
检测数量(万人份)
|
30
|
50
|
70
|
90
|
110
|
130
|
|
10
|
1300
|
3.9
|
6.5
|
9.1
|
11.7
|
14.3
|
16.9
|
|
20
|
2600
|
7.8
|
13
|
18.2
|
23.4
|
28.6
|
33.8
|
|
30
|
3900
|
11.7
|
19.5
|
27.3
|
35.1
|
42.9
|
50.7
|
|
40
|
5200
|
15.6
|
26
|
36.4
|
46.8
|
57.2
|
67.6
|
|
50
|
6500
|
19.5
|
32.5
|
45.5
|
58.5
|
71.5
|
84.5
|
|
60
|
7800
|
23.4
|
39
|
54.6
|
70.2
|
85.8
|
101.4
|
|
70
|
9100
|
27.3
|
45.5
|
63.7
|
81.9
|
100.1
|
118.3
|
|
80
|
10400
|
31.2
|
52
|
72.8
|
93.6
|
114.4
|
135.2
|
|
90
|
11700
|
35.1
|
58.5
|
81.9
|
105.3
|
128.7
|
152.1
|
|
100
|
13000
|
39
|
65
|
91
|
117
|
143
|
169
|
|
110
|
14300
|
42.9
|
71.5
|
100.1
|
128.7
|
157.3
|
185.9
|
|
120
|
15600
|
46.8
|
78
|
109.2
|
140.4
|
171.6
|
202.8
|
|
130
|
16900
|
50.7
|
84.5
|
118.3
|
152.1
|
185.9
|
219.7
|
|
140
|
18200
|
54.6
|
91
|
127.4
|
163.8
|
200.2
|
236.6
|
|
150
|
19500
|
58.5
|
97.5
|
136.5
|
175.5
|
214.5
|
253.5
|
注:销售额=全球单日检测量*检测试剂盒单价*延续时间;海外42个国家单日历史峰值检测量合计约为130.09万人份,假设海外检测试剂盒单日检测量为130万人份(截至4月29日);价格参考中国市场单价约30-130元/人份
核酸检测成本高,抗体检测适用于大规模初筛。可用于现场筛查,定性检测,操作简单,适用于大规模初筛,但灵敏度相对低,检测时间约为2-30分钟,从检测成本来看,抗体检测一般仅需要试剂盒、人力成本,相比核酸检测成本低廉,更加适用于医疗资源不足的中低收入国家或地区。
新冠病毒检测试剂盒情况梳理
|
试剂盒分类
|
应用场景
|
特点
|
检测时间(分钟)
|
检测成本构成
|
|
核酸检测
|
生物二级安全实验室及以上
|
样本灭活安全保存、自动核酸提取、快速扩增检测,具备高灵敏度、高特异性、高自动化
|
90-180
|
实验室建设、维护+仪器设备+检测试剂盒+力成本
|
|
抗体检测
|
现场筛查
|
定性检测,操作简单,适用于大规模初筛,但灵敏度相对低
|
2-30
|
检测试剂盒+人力成本
|
2、发达国家第三方检验发挥重要作用,低收入国家更适用抗体检测
美国针对符合条件的地区制定三阶段复工指引,病毒检测及接触者追踪能力为必备条件。在2020年4月17日,美国总统特朗普已经制定了各州分三阶段重启经济的指引,指引规定各州核心职责是实现对病毒检测及接触者的追踪、提升关键医疗能力、尽可能保护复工人员的健康和安全,以免疫情发生恶化。
美国复工计划指引
|
-
|
具体情况
|
|
各州复工条件
|
14天内疑似和确诊病例持续减少。医院恢复疫情前的状况。各州医院没有重症,建立安全有效的筛查和检测,医护人员得到充足的个人防护设备
|
|
各州核心职责
|
1.病毒检测及接触者追踪:能够快速为有症状的个体建立安全有效的筛查和检测点,并追踪COVID+患者的接触者;检测综合征/ILI(流感样)患者COVID的能力和COVID+患者的接触者;确保对老年人、低收入者、少数民族和美洲原住民服务点的无症状病例的监控筛查
|
|
2.医疗系统能力:能够快速独立地提供足够的个人防护设备和关键医疗设备以应对急剧增长的需求;应对ICU病人提升的能力
|
|
|
3.计划实施:保护复工人员安全;就社交距离和戴面罩事宜向公民提供指导;保持监测并立即采取措施,通过重新启动某阶段防控措施或返回到早期阶段防控来缓解任何疫情反弹或爆发
|
|
|
三阶段复工计划
|
第一阶段(~14天):继续尽可能远程办公、分阶段复工、减少非必要旅行、并保持社交距离措施
|
|
第二阶段(~14天):(公共卫生事件无反弹迹象的州)可恢复不必要旅行,学校和有组织的青年活动可重新开放,在采取社交距离措施的情况下可重新开放酒吧、体育馆和大型场所
|
|
|
第三阶段(~14天):脆弱人群可恢复搭乘公共交通,但应保持距离,低风险人群应考虑尽量减少在人群
|
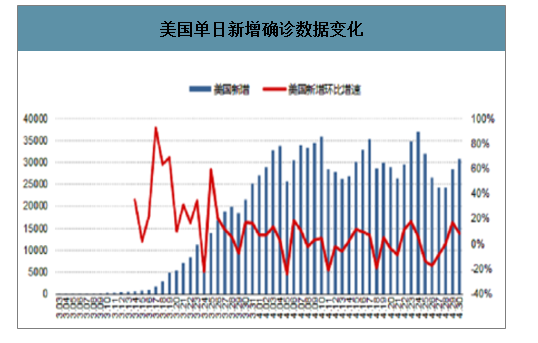
美国检测能力大幅提升,检测阳性率逐渐下降。从美国角度来看,美国单日检测能力逐渐提升,在4月22日,美国单日检测量大幅提升至30万人以上,当日检测阳性率大幅降低,更大范围的检测、筛查与感染患者的追踪、监控基本可以提供疫情的有效防控的基础。
美国单日新增确诊数据变化
数据来源:公开资料整理
美国单日检测阳性率变化
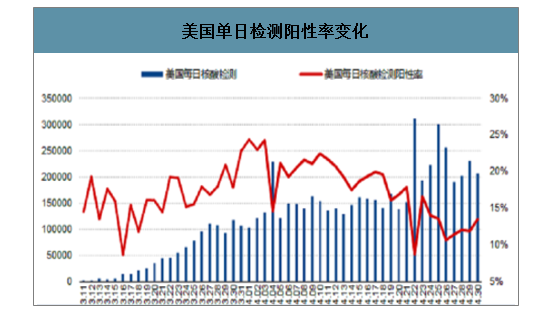
数据来源:公开资料整理
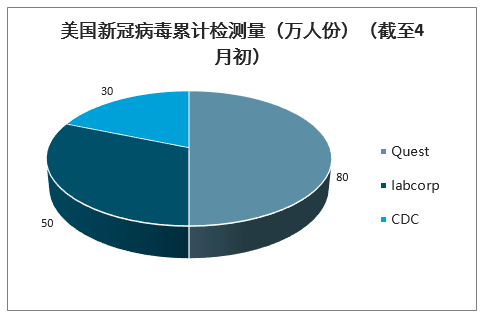
第三方独立医学检验实验室为检测的主力军。美国CDC的工作重点是公共卫生的支持,作为应急储备,检测任务基本由独立医学检验实验室承担。截至4月初,美国ICL独立医学检验实验室Quest检测量为80万人份,labcorp检测量为50万人份,CDC检测量(CDC+公共卫生实验室)不到30万人份,合计达到160万人份。
美国CDC的工作安排情况
|
分类
|
具体工作安排
|
|
公共卫生支持
|
验证其他诊断方式,提供给公共卫生部门的更多的选择;作为储备应急力量,保持足够的应对激增病例的能力
|
|
检测工作
|
将更多的检测任务交给公共卫生实验室(PHL)和独立医学实验室(ICL)
|
美国新冠病毒累计检测量(万人份)(截至4月初)
数据来源:公开资料整理
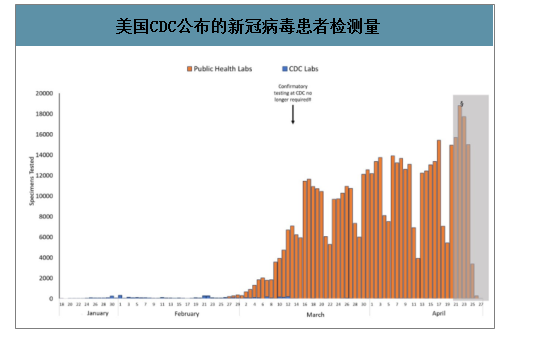
美国CDC公布的新冠病毒患者检测量
数据来源:公开资料整理
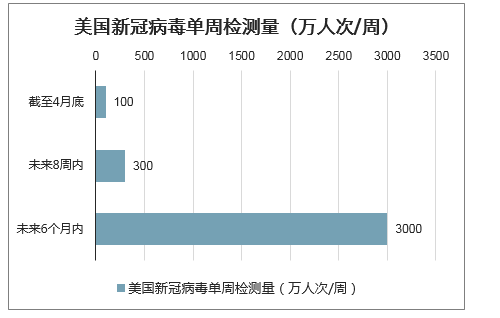
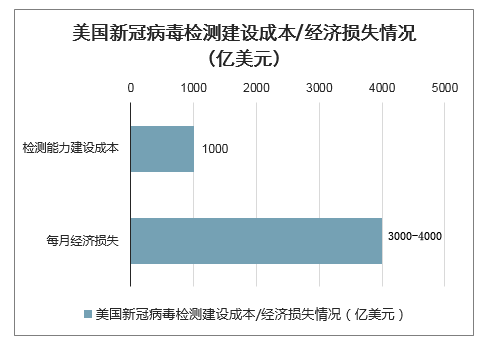
计划千亿美元检测成本投入,大幅提升美国检测能力至3000万人次/周。在新冠疫情全面爆发以来,美国因疫情导致的经济损失达到约3000亿美元/月至4000亿美元/月,洛克菲勒基金会最近提出实施成本高达1000亿美元(约合7100亿元人民币)的“历史上最大规模的公共健康检测”计划,要求将美国的新冠病毒检测能力未来8周内提高至300万人次/周,未来6个月内提高到3000万人次/周。
美国新冠病毒单周检测量(万人次/周)
数据来源:公开资料整理
美国新冠病毒检测建设成本/经济损失情况(亿美元)
数据来源:公开资料整理
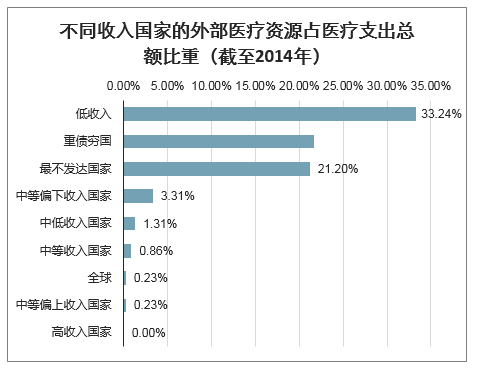
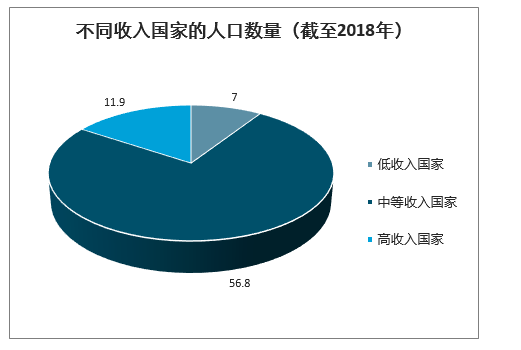
中、低收入国家医疗资源对外依赖程度高,POCT类产品更适于广泛应用。根据不同收入国家的外部医疗资源占医疗支出总额比重(外部资源包括从国外进入国家卫生系统的所有资金流入)来看,低收入国家、重债国家、最不发达国家严重依赖医疗资源进口。随着新冠肺炎疫情在全球范围内的传播,该部分国家可调度的应急医疗资源严重匮乏。其中,全球低收入国家覆盖人口达到约7.0亿人,面对新冠疫情的传播,低收入国家急需海外进口以满足疫情需求,尤其是使用便利的是POCT产品更适于大规模推广。
不同收入国家的外部医疗资源占医疗支出总额比重(截至2014年)
数据来源:公开资料整理
不同收入国家的人口数量(截至2018年)
数据来源:公开资料整理
印度积极推广快速检测病毒抗体的方法(POCT)。截至4月29日,印度国内的新冠病毒检测能力大幅提高至约4万人份/天以上,定点医院约4000家,隔离病床数约19.4万余张,但印度全国城市人口中有17%生活在贫民窟,核酸检测率低,相比巨大的人口密度,当前的核酸检测能力、隔离病房数量不足以应对疫情的聚集性爆发。因此,印度当局积极推广快速检测病毒抗体的方法(POCT)。印度已于4月24日宣布增加进口300万份病毒检测试剂盒,其中150万份分别从万孚生物、丽珠集团进口。
印度新冠病毒检测能力情况(截至4月29日)
|
分类
|
检测能力(万人份)
|
来源
|
备注
|
|
核酸检测
|
>4
|
自建
|
印度全国城市人口中有17%生活在贫民窟。人口密度大、居家隔离难、核酸检测率低,一旦这些贫民窟发生聚集性疫情,印度疫情防控系统和医疗系统都将面临前所有未的压力
|
|
抗体检测
|
300
|
进口,其中150万份分别从万孚生物、丽珠集团进口
|
印度积极推广快速检测病毒抗体的方法,快速检测试剂仅用于监控疫情,不能用于确诊病例判断,不能代替核酸检测
|
- 上一篇:客户采用链霉亲和素磁珠捕获DNA探索DNA主动去甲基化新途径 2020/7/18
- 下一篇:后新冠检测时代,体外诊断行业下一个机遇是啥? 2020/7/4
