磷酸化蛋白质和 磷酸化肽段的富集方法概述
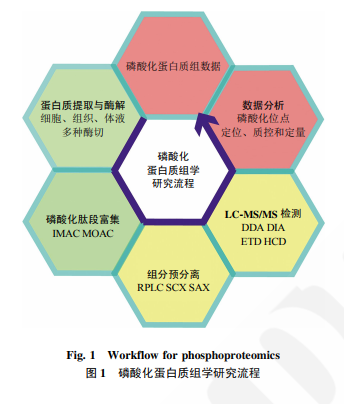
蛋白质翻译后修饰 (post-translational modification,PTM)可以改变蛋白质结构和活性、 介导细胞信号转导,细胞对外界环境刺激的响应往往通过PTM实现。PTM类型众多,包括磷酸化、 乙酰化、泛素化和糖基化等.在众多类型的 PTM 中,磷酸化是最受关注的。磷酸化修饰是一 种可逆的蛋白质修饰,通过磷酸化修饰的变化,可以调控蛋白质活性、影响信号传递过程。磷酸化修饰是细胞健康和疾病的核心调控机制之一,依靠众 多种类激酶和磷酸酶,细胞可以迅速地增加或减少蛋白质的磷酸化修饰,实现复杂而精确地调控。真核生物中约有 1/3 的蛋白质具有磷酸化修饰,这也体现了磷酸化修饰的普遍性和重要性。磷酸化蛋白质组学在过去20年间发展迅速,多种生命过程都用磷酸化蛋白质组进行了描绘.如对细胞周期的磷酸化解析、不同小鼠组织磷酸化差异谱图、胰岛素分泌机制等。此外,磷酸化蛋白质组研究应用于多种临床问题研究,推动了人们对疾病发病机制的认知,并提供了一系列临床疾病治疗靶点和治疗方案。比如通过外泌体中蛋 白质磷酸化筛选乳腺癌生物标志物、通过小鼠脑不同区域G蛋白偶联受体 (G protein-coupled receptor,GPCR)的激活研究药效和药靶等。 基于质谱的自下而上(down-top)的蛋白质组研究方法是常见的解析磷酸化蛋白质组方法,下面重点讨论下磷酸化肽段富集。
磷酸化修饰肽段的丰度相对整体细胞而言是很低的,直接地全覆盖质谱检测,非磷酸化的肽段会形成很高的背景信号,影响磷酸化肽段的检测。因此磷酸化肽段的检测,首先需要进行富集;此外,对样品进行预分离、分成多个组分,也是降低复杂程度、提高检测深度的常用方法。
1. 富集方法分类
磷酸化肽段的富集方法,是整个实验流程中最多变的部分。磷酸基团与金属亲和的方案是最流行的方案,其中应用最广泛的两种是固相金属离子亲和色谱(immobilized metal affinity chromatograph, IMAC)和金属氧化物亲和色谱(metal oxide affinity chromatography,MOAC)。
IMAC 建立时间约有20 年,利用过渡态金属阳离子,如 Fe3+、Ga3+、 Zr4+ 等,作为亲和试剂,与阴离子结合.Ti4+ 离子是该类试剂中新兴的应用。这些金属阳离子通过螯合作用,固定在具有磁性的磁珠或硅颗粒上, 从而在去除非磷酸化肽段的过程中能够保留磷酸化的肽段。厦门普睿迈格生物公司的IMAC磁珠(Ti螯合磁珠 MagStart-IMAC-Ti——蛋白质组学前处理MagReSyn®-Ti-IMAC-生物磁珠专家、Zr螯合磁珠 MagStart-IMAC-Zr——高结合量蛋白质组学前处理MagReSyn®-Zr-IMAC-生物磁珠专家、NTA磁珠 MagStart-NTA——高结合量蛋白质组学前处理MagReSyn®NTA-生物磁珠专家)表现优异,是最常用选择。
MOAC 方法建立约 10 年,利用氧化金属可以和磷酸根基团中的氧结合的特性进行磷酸化肽段的富集。氧化钛(TiOx)是最常用的 MOAC 试剂, 此外 Fe3O4 也比较常见。厦门普睿迈格生物公司的二氧化硅磁珠可特异富集磷酸化蛋白多肽(磷酸化多肽富集磁珠|硅基TiO2磁珠|二氧化钛磁珠-生物磁珠专家)。
IMAC 和 MOAC 方法都可以对磷酸化肽段或者蛋白质进行富集,二者都容易受到酸性肽段影响,比如多羧基集团的肽段会发生非特异性结合。IMAC 所得样品容易含有金属离子或者金属 盐的污染,需要进行脱盐处理.并且 IMAC 方法对多磷酸化修饰的肽段具有偏好性,容易丢失单磷酸化修饰的肽段。和 IMAC 相比,MOAC 方法灵敏度更高、选择性更好。由于金属氧化物具有很好的稳定性,因此 MOAC 方法对 pH 值等环境因素的改变具有更好的耐受。 IMAC 和 MOAC 方法都是针对丝氨酸、苏氨酸和酪氨酸的磷酸化修饰位点(pSer、pThr、pTyr) 进行富集的方法。Matheron 等2014 年比较了两种方法对HeLa 细胞中的磷酸化富集,发现只有 40%磷酸化肽段是重合的.不过,在肽段长度、位点和模序(motif)等方面,二者并没有明显的不同。最重要的是,生物学的差异,而不是方法上的差异,对结果起到最主要的影响.
免疫共沉淀方法,是专门用于富集酪氨酸磷酸化的主流方法,结合了基于金属的富集方法和基于 抗体的富集方法中的优势,该方法能够高特异 性的对酪氨酸磷酸化位点进行富集.目前,针对酪氨酸的特异性抗体正在不断涌现.
2. 富集方法的发展
肽段的检测深度依赖于酶解效率、传统的胰酶 (trypsin)酶解,能够在赖氨酸和精氨酸的 C 末端进 行剪切。但通过对不同酶的比较,发现两种不同酶的酶切后,检测到的磷酸化位点只有 1/3 的重合,这说明不同酶酶切后检测到的位点不同。利用多种酶共同作用,可以提高酶切效率,提升检测 的覆盖深度。比如利用 LysC 和胰蛋白酶(trypsin) 共同酶解,可以提高 40%的磷酸化检测位点。 预分离也是提高鉴定深度的方法。反向液相预分离(reversed phase liquid chromatograph,RPLC)是 常用的分组分方法,此外还有强阳离子交换(strong cation exchange,SCX)和强阴离子交换(strong anion exchange,SAX)方法。Ruprecht 等在比较不同 富集方法时发现,通过亲水强阴离子交换预分离, 48 h 的检测可以获得 15000 条磷酸化肽段,要比 4 h 检测 5500 条磷酸化肽段的鉴定深度有所提 高。此外,覆盖度的提升,使得数据间的相关性明显提升。强离子交换方法可以和 TiOx 富集方法结合,但是还没有和抗体富集方法结合的例子。 Batth 等在 2014 年比较了 SCX 和 RPLC 分组分方法,发现 RPLC 方法能够鉴定到更多的磷酸化肽段,RPLC 方法鉴定到 17 566 条磷酸化肽段, SCX 方法鉴定到 6215 条肽段。并且 RPLC 方法实 验流程更加简便,不用额外替换溶液环境。也有一些亲和方法,用于富集磷酸化的蛋白质 而非肽段.因为蛋白质常以复合物形式行使功能, 因此该方法能够鉴定细胞中复合物的情况。如 Hoehenwarter 等利用 Al(OH)3 富集促细胞分裂剂激活的蛋白激酶.目前,该领域还在持续发展中。
- 上一篇:国内磁微粒化学发光免疫检测技术厂家情况介绍 2019/3/3
- 下一篇:CRISPR/Cas9基因魔剪成了分子诊断的新帮手 2019/2/11

