生物工艺中超越分析规模的磁性分离:从生物技术到食品工业
Sebastian P. Schwaminger1*†, Paula Fraga-García1*†, Marco Eigenfeld2, Thomas M. Becker2, Sonja Berensmeier1*
1德国加兴慕尼黑工业大学机械工程系生物分离工程组
2德国弗赖辛慕尼黑工业大学酿造和饮料技术研究所饮料和谷物生物技术研究小组
下游工艺需要更多创新理念来推进和克服当前的生物工艺挑战。色谱法是迄今为止保守的工业部门使用的最普遍的技术。层析法具有许多优点,但也往往是制药生产过程中最昂贵的步骤。因此,迫切需要替代方法和深加工策略。磁分离是大规模新开发的一个有前途的候选者,它能够快速、直接地捕获发酵液中的目标分子。在过去的 10-20 年里,该领域发生了一场小革命,已经发表了一些关于在分析规模以外的生物工艺实例中使用磁性分离的论文。由于每种目标材料都使用不同的磁分离方法进行纯化,因此工艺比较并非易事,但有助于理解和改进磁分离,从而使其对技术规模具有吸引力。为了解决这个问题,我们报告了磁性分离技术的最新成果,并概述了捕获和分离生物技术和食品技术衍生的生物分子的进展。磁分离在应用生命科学中具有巨大的高通量下游加工潜力。同时,需要克服两个主要挑战:(1) 开发合适和灵活的分离装置平台,以及 (2) 对有利的加工条件进行额外研究,尤其是在回收期间。需要改进浓度和纯化因子,为更广泛地使用磁性应用铺平道路。磁性梯度和多用途分离的创新组合将为大规模下游工艺设定基于磁性的新趋势。
介绍
许多科学发现都与磁现象直接相关。从使用指南针的勘探航行到电力的开发,再到铁矿石的加工,磁学已经彻底改变了传统工艺。磁分离是由磁场在磁敏感材料中感应的力引起的,而其他材料则不受这种力场的影响。源自采矿业的磁分离的首次使用可以追溯到 20 世纪初 (库斯特,1902 年).随着时间的推移,应用领域扩大到包括煤脱硫、钢铁生产、废水处理、医疗应用和生物技术 (Robinson 等人,1973 年; Whitesides 等人,1983 年; Moffat 等人,1994 年; 周 et al., 1996; Yavuz 等人,2006 年; Gómez-Pastora 等人,2014 年; Egesa 等人,2017 年).所有这些应用程序有什么共同点?在水介质中加工的条件是相似的。然而,处理的总体积和过程粘度存在显著差异,这可能会给磁分离带来挑战。与废水流相比,以蛋白质或药物为主要产品的生物技术过程处理较低的水体积、较高的粘度和较高的目标分子浓度。食品技术过程与生物技术中的过程相似。在大多数情况下,目标没有磁性。根据这些靶材和磁性材料之间的不同相互作用,它们可以与周围的介质分离。体内热疗或药物输送治疗等医疗应用需要处理更低的水量、更高的纯度和更低的毒性。因此,根据基本的生产工艺和分离要求,需要不同的磁性材料。虽然环境方法的主要目标是过滤杂质并获得清洁水,但在生命科学中,其目标通常是从混合物中仅去除一种目标物质。
在过去几年中,随着新的应用趋势,用作生物分子载体的材料和磁分离器设计得到了进一步发展。我们回顾了生物技术和食品技术的工业相关磁分离工艺,重点关注过去二十年的进步。我们表明,在更大规模上实现的生产力水平对于工业开发来说是有趣的。也许目前最紧迫的任务是鼓励开发用于磁分离工艺的增强型设备,并提供最佳工艺参数的示例。需要新的工艺来提高生产率,一次回收多种目标材料,并减少时间周期和水消耗。在以下部分中,我们想重点介绍磁性分离在制药和食品工业领域的使用方式,以及需要考虑哪些参数才能纯化细胞和生物大分子(如蛋白质)。
磁分离的优势
生物技术来源的制药应用(例如抗体生产)的常规分离和纯化方法需要许多步骤:过滤、离心、絮凝、沉淀或结晶以及色谱技术 (Carta 和 Jungbauer,2010 年)。开发高科技或创新方法仍然是在领先技术领域促进下游加工和为提高生产力铺平道路的主要挑战。由于一些重要的优点,磁性分离是未来下游应用的有趣候选者:
• 整合了靶标的一步捕获和纯化(高亲和力和选择性)
• 高通量
• 半连续加工,能耗低。
因此,与传统工艺相比,磁分离有助于降低成本并提高产量和生产率。在相对较低的压力下进行连续或半连续加工,加工能耗较低。该过程允许一个广泛的变量框架来使其适应每个系统的需求,并应导致更多可用于工业开发的生物产品(Hubbuch 等人,2001 年; Ohara 等人,2001 年; Ahoranta 等人,2002 年; Eskandarpour 等人,2009 年; Yavuz et al., 2009; Paulus et al., 2014; Gómez-Pastora 等人,2017 年).
分离策略和分离器设计
在开始分离过程之前,第一步是选择最合适的分离策略。这意味着要考虑系统和流程,并考虑所有相关参数。方案图 1重点介绍了设计高效流程的主要标准。有必要牢记加工限制(体积、目标、肉汤特性、时间、成本等)和合适设备的可用性。表 1概述了磁分离原理,而图 2介绍了一些现有设计的设置。分离策略取决于目标分子,不仅包括实际的磁性分离过程,还包括磁性材料与目标分子之间的相互作用。靶标的结合和洗脱条件对整个过程至关重要,结合的平衡时间,尤其是洗脱的平衡时间仍然是未来优化的挑战。
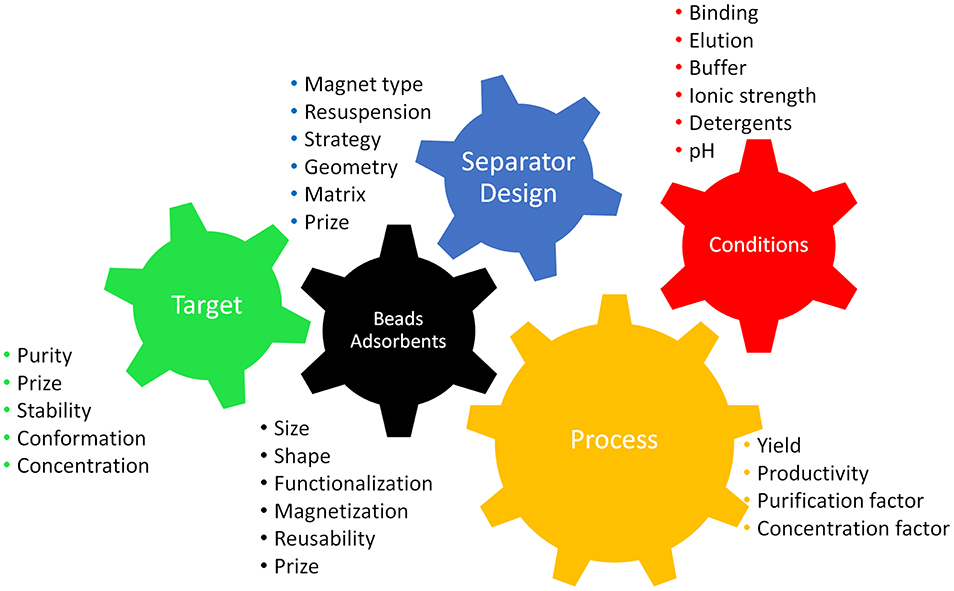
图 1.该方案突出了磁分离过程的主要标准,就像机器中的齿轮一样相互啮合,因为它们相互依赖。需要根据目标产品选择参数,以促进高效的过程。
表 1.生物技术下游加工的磁性分离策略总结
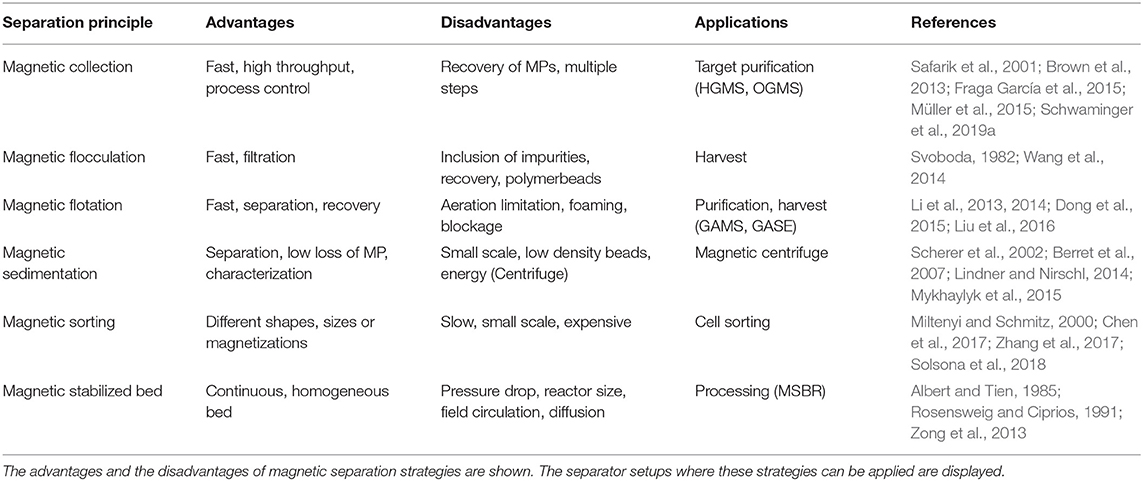
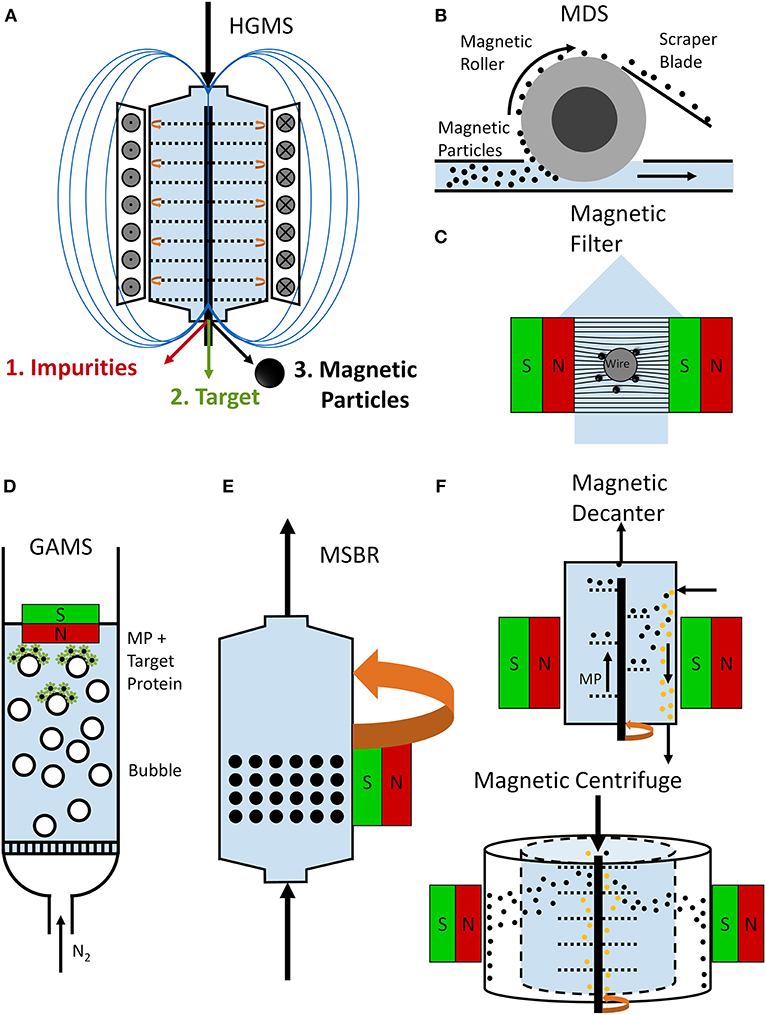
图 2.磁选机设计方案。转子-定子高梯度磁选机 (A) 可用于纯化目标蛋白。在这里,电磁铁用于在多孔板(转子板和定子板)之间建立高磁场梯度。第一步,目标材料吸附到磁性颗粒上,并通过磁性与分离室中的杂质分离。在第二步中,将磁性颗粒与目标蛋白分离,目标蛋白被洗脱 (Fraga García et al., 2015; Schwaminger等人,2019 年).图中展示了磁鼓式分离器 (MDS) 形式的开放式梯度磁选机 (OGMS) (B)。使用磁鼓将磁珠与杂质分离,并用刮刀刀片 (Dong et al., 2015).在磁过滤装置 (C) 中,可磁化的导线、网格或束被放置在磁场中。磁性颗粒与这些可磁化基质结合,形成可磁化滤饼,从而提高磁性滤光片的性能 (Schwaminger 等人,2019b).在气体辅助磁分离 (GAMS) 工艺 (D) 中,气体通过反应器鼓泡,导致磁性颗粒和附着的目标分子浮选,这些目标分子可以用磁铁 (Li et al., 2013).磁稳定移动床反应器 (MSBR) 基于反应器周围的旋转磁场,允许磁珠流化,同时它们在流向 (E) 上的行为类似于固定床 (Zong 等人,2013 年).磁力卧螺离心机 (F) 允许磁性颗粒与磁化螺杆连续传输,同时杂质不受磁场影响,因此与磁性材料分离 (Lindner 和 Nirschl,2014 年).磁力离心机 (G) 由于磁珠的密度差异和磁化 (Lindner 和 Nirschl,2014 年).
磁敏感材料的几种物理特性用于分离磁场中的分子 (Moffat 等人,1994 年)。磁性分离的典型应用是直接收集磁性材料并将其与非磁性材料分离。这种方法使用高磁场梯度来成功收集所有磁性材料。另一种选择是利用磁性材料的聚集和团聚效应,因为在磁场 (Svoboda,1982 年; Ditsch 等人,2005 年).与斯托克阻力和布朗运动的影响相比,由于磁力更大,这种所谓的磁絮凝可以更容易地进行分离;此外,由于与单个颗粒相比,聚集体的尺寸更大 (Schwaminger 等人,2019b).缺点是这种磁聚集通常会对磁性收集产生负面影响,使磁性材料的重复使用更具挑战性。
Eichholz 等人提出的一个有趣的过程是磁性过滤,它将磁性分离与滤饼过滤 (Eichholz 等人,2011 年).其他可能性包括磁浮选、增强磁沉降、磁选或在磁稳定床中使用磁珠作为吸附材料 (Albert 和 Tien,1985 年; 查尔斯,1990 年; Rosensweig 和 Ciprios,1991 年; Moffat 等人,1994 年; Becker et al., 2009).磁浮选可用于收集或增强浮选效果,并有效地从杂质中分离和捕获目标分子。气体辅助磁分离 (GAMS) 和气体辅助超顺磁萃取 (GASE) 工艺使用氮气气泡漂浮与目标分子结合的磁性纳米颗粒 (Li et al., 2013; Liu et al., 2016).磁性颗粒可以在萃取阶段收集,也可以使用磁铁收集,从而实现快速分离过程。磁力离心机可以进一步增强磁沉降,磁力离心机通过增加磁珠上的加速力 (Lindner 和 Nirschl,2014 年).磁性分拣可用于根据磁性和磁性对磁性材料和与这些磁性材料结合的材料进行分类。这有利于对不同形状和大小的磁性纳米颗粒进行分选,以及对细胞进行分选 (Chen et al., 2017; Zhang et al., 2017).磁稳定床反应器促进了固定床和移动床之间的混合,从而允许在磁珠表面发生化学反应,催化剂和酶可以固定在那里 (Zong 等人,2013 年)。
磁性材料
磁性材料是分离过程中必不可少的成分。磁分离尤其受益于医疗技术领域(例如药物输送)的强劲发展以及多功能磁性材料的发展。氧化铁纳米颗粒通常被认为是安全的 (GRAS),并已获得美国食品和药物管理局 (FDA) 的体内应用批准 (Thanh,2012 年; Pušnik 等人,2016 年).此外,根据 FDA 的规定,氧化铁允许作为色素和食品添加剂。关于氧化铁纳米颗粒的毒性和可能的健康影响,有多种研究:一方面,氧化铁纳米颗粒能够穿透细胞并产生活性氧 (ROS),这会导致细胞损伤(Soenen 等人,2011 年; Liu et al., 2013)。另一方面,多项研究并未表明氧化铁纳米颗粒对健康的影响(Szalay 等人,2012 年)。这一争议以及氧化铁纳米材料的潜在毒性需要进一步调查和评估,以确保安全处理纳米材料用于磁分离 (Auffan et al., 2009; Valdiglesias 等人,2015 年)。许多综述介绍了不同磁性粒子的合成,尤其是在纳米水平上,以及大量的磁性粒子功能化策略(Bergemann 等人,1999 年; Berensmeier, 2006 年; Lu et al., 2007; Laurent 等人,2008 年; Philippova 等人,2011 年; Buck 和 Schaak,2013 年; Conde 等人,2014 年; Xiao et al., 2016; Ge et al., 2017).合成方法会影响颗粒核心及其表面特性 (Laurent 等人,2008 年; Shavel 和 Liz-Marzán,2009 年; Roth et al., 2015)。单独对于氧化铁,从共沉淀到水热合成,从研磨到生物合成,多种策略是已知的 (Laurent 等人,2008 年; Ali et al., 2016)。超顺磁性纳米颗粒可用于合成或嵌入聚合物基质中的分离过程,通常会导致微载体 (Philippova 等人,2011 年)。这些微载体 (表 2)代表磁分离应用中最常用和市售的颗粒 (Berensmeier, 2006 年; Borlido et al., 2013; Fields 等人,2016 年)。纳米颗粒比微粒珠和层析填料具有优势,因为在分离过程中蛋白质扩散没有传质限制,这在容量、纯度、污染水平和处理时间方面很重要。非嵌入磁性纳米颗粒,如裸露的氧化铁纳米颗粒,由于其生产成本低、前驱体丰富和密度高,在分离过程中具有很大的潜力。另一方面,磁性微珠在分离过程中更容易处理,因为它们不易受到磁聚集效应的影响。因此,与胶体稳定的纳米颗粒相比,较大的尺寸有助于在磁力和斯托克斯阻力之间实现更好的比率,从而在磁场中具有更好的可分割性。最佳磁性材料的选择在很大程度上取决于工艺策略。目标生物材料和工艺条件在磁珠的选择中也起着至关重要的作用(参见图 1)。根据奖品和目标产品的要求,需要使用低成本的粗裸氧化铁纳米颗粒或高度特异性的吸附剂,如蛋白 A 修饰的磁性颗粒,用于纯化过程(Holschuh 和 Schwämmle,2005 年; Gomes 等人,2018 年; Schwaminger等人,2019 年,b)。此外,必须根据磁珠化学和工艺设计准确选择靶蛋白的结合和洗脱条件。磁性表面的功能化是一个工具包,可以根据目标的特性以及所选的吸附和解吸之间的切换条件进行调整。总之,根据应用的不同,需要选择和组合磁性材料、粒径、稳定性和功能化 (图 3)。
表 2.选择用于生物技术纯化和医疗应用的市售磁珠

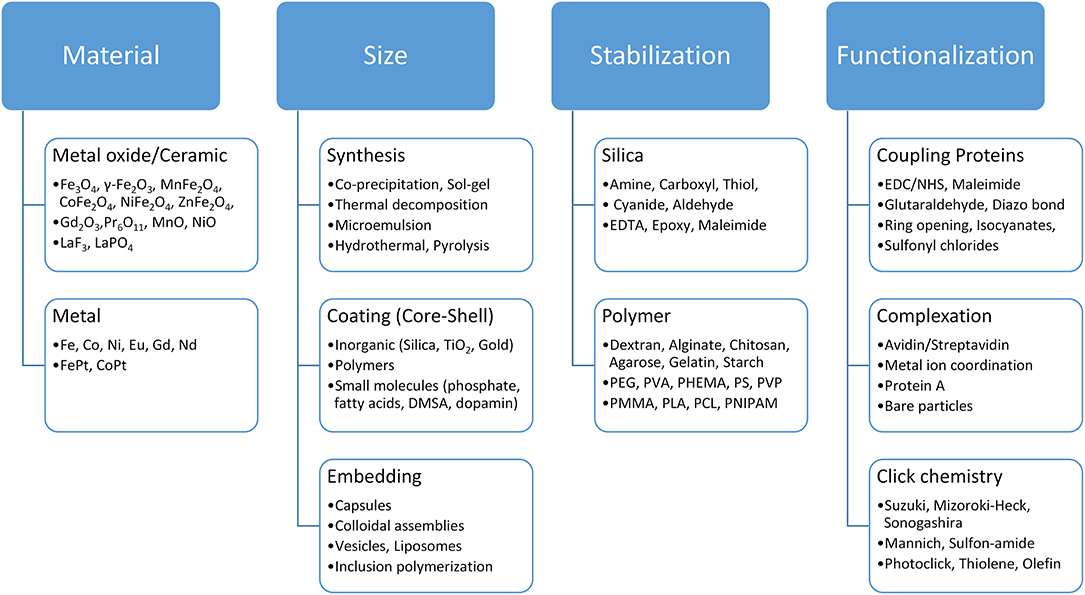
图 3.用于根据应用选择合适的磁珠的工具包。粗金属或陶瓷颗粒的选择以及稳定和功能化磁性颗粒的策略对其在生物分离过程中的应用起着决定性的作用。
用于生物技术蛋白质和细胞回收的高梯度磁性分离
高梯度磁选机在特斯拉范围内具有较大的磁通密度,允许 10、4-10、5 T/m 或更高的局部梯度 (Svoboda 和 Fujita,2003 年; Las Cuevas 等人,2008 年)。它们能够从流动流中捕获具有较弱磁矩的材料 (Yavuz et al., 2009)。因此,新兴的磁性技术导致了实验室规模上生物分子(尤其是蛋白质)的不同分离工艺的发展。然而,只有少数研究小组的工作致力于更大规模地开发磁性分离,以回收蛋白质、其他生物分子甚至细胞 (Hubbuch 等人,2001 年; Hoffmann 等人,2002 年; Hubbuch 和 Thomas,2002 年; Bucak et al., 2003; Heebøll-Nielsen 等人,2004 年b; Hoffmann 和 Franzreb,2004 年a,b; Moeser 等人,2004 年; Kampeis 等人,2009 年,2011,2013; Lindner 和 Nirschl,2014 年; Nirschl 和 Keller,2014 年; Fraga García et al., 2015; Roth 等人,2016 年; Gomes 等人,2018 年; Schwaminger等人,2019 年,b)。
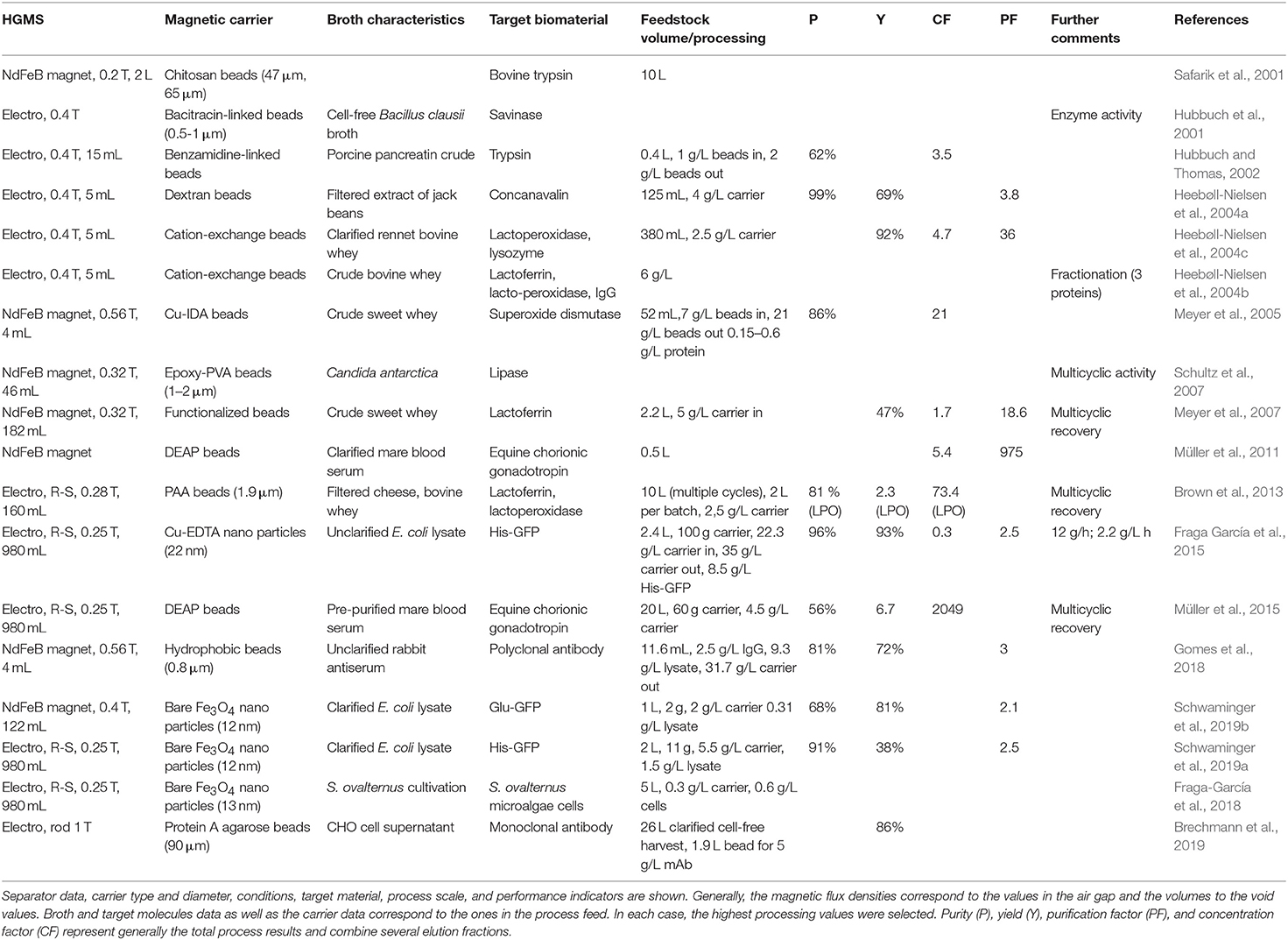
一些全自动 HGMS 模型 (Hubbuch 等人,2001 年; Hoffmann 等人,2002 年; Heebøll-Nielsen 等人,2004 年a; Hoffmann 和 Franzreb,2004 年a,b; Meyer 等人,2005 年)以及 Franzreb 及其同事的一系列专利开创了大规模生命科学应用高梯度磁分离的新纪元。2006 年,发明了所谓的转子定子分离器 (Franzreb et al., 2004; Franzreb 和 Reichert,2006 年).该模型具有显著的优势,即洗脱、洗涤和颗粒回收步骤的效率大大提高。因此,转子-定子型分离器可用于扩大传统磁珠应用之外的磁分离过程。基于转子定子设计 (Franzreb 和 Reichert,2006 年),一些分离器原型是与 Steinert GmbH 和 Abbis GmbH 合作构建的。原型以及 HGMS 加工步骤已得到精确描述 (Brown 等人,2013 年).最近与 Andritz KMPT GmbH 合作对 HGMS 模型进行了调整,以符合 cGMP 标准(Ebeler等人,2018 年)。
转子定子分离器的一个有趣特点是多循环过程设计简单,这导致更高的总产量,使其成为高价值目标生物分子的更好选择。Schultz 等人和 Meyer 等人之前曾介绍过使用其他分离机进行多循环蛋白质回收,但重悬颗粒的挑战、回混和不完全冲洗导致的问题仍然存在 (Meyer 等人,2005 年; Schultz et al., 2007)。Müller 和合作者使用转子定子 HGMS 运行一个超过 60 个循环的工艺,前 12 个循环中的结合载量损失非常低 (<10%);在一个批处理过程中,作者实现了高达 4,900 (Müller et al., 2011)。
磁性分离器通过以下方式捕获药学相关蛋白质Holschuh 和 Schwämmle (2005)。他们在 100 L 规模的细胞培养上清液中用蛋白 A 修饰的磁珠纯化抗体。最近,类似的加工方法已经得到改进并适用于转子定子系统 (Müller et al., 2015; Gomes 等人,2018 年).这些工作清楚地表明了 HGMS 在更大规模直接捕获生物靶标方面的相关性。Gomes 等人在小型中试规模上使用 HGMS 从未过滤的兔抗血清原料中回收多克隆抗体。它们使用 0.8 μm 功能化颗粒从进料中 2.5 g/L 的初始抗体浓度中回收抗体,在 0.5 小时内以 3 倍纯化形式 (Gomes 等人,2018 年)。Müller 从高达 20 L 的马血清中纯化糖蛋白马绒毛膜促性腺激素 (eCG),并使用转子定子 HGMS (Müller et al., 2015)。在最近的一项研究中,Brechmann 等人展示了使用 HGMS 从 26 L CHO 细胞上清液中纯化单克隆抗体,并获得与色谱工艺相同的纯度 (Brechmann et al., 2019)。
最近,升级 HGMS 的另一个重要突破是使用磁性纳米颗粒(而不是微粒)进行蛋白质回收 (Fraga García et al., 2015)。已成功应用高达 100 g 质量的包被纳米颗粒,以每小时从 2.4 L 细胞裂解物中回收 12 g His-GFP。在那之前,许多研究人员都认为 HGMS 不适合分离非常小的磁性颗粒 (<100 nm) (Kim et al., 2009),尽管 Hatton 小组的早期工作已经证明了包被纳米颗粒在 mL 级工艺中的适用性 (Bucak et al., 2003; Moeser 等人,2004 年).两部新作品 (Schwaminger等人,2019 年,b)提供了 HGMS 使用技术和工业上都非常有趣的材料的可能性的证据:低成本的裸氧化铁纳米颗粒。这两项工作都展示了基于纳米颗粒的升级分离在实现更高容量方面的优势。此外,Schwaminger 等人还揭示了洗脱过程,无需使用危险且昂贵的洗脱液(如咪唑)。这证明了提高结果和转向更可持续的加工形式有很大的余地,这有望成为下游加工的未来重点之一。Schwaminger等人,2019 年)。
最近还发表了另一个使用升级 HGMS 裸露的氧化铁纳米颗粒成功分离以回收整个细胞而不是蛋白质的例子 (Fraga-García et al., 2018),尽管磁性电池分离的基础可以追溯到 1975 年 (Melville 等人,1975 年)。在细胞分离的情况下,更快的处理速度和高回收率的优势在几十年前就得到了认可 (Kronick 等人,1978 年),尽管磁性材料通常仅用于标记细胞 (Molday 等人,1977 年)。最近的出版物强调了细胞纯化的更大规模可能性 (Hultgren 等人,2004 年) 和过去二十年中获得的相关性 (Berger et al., 2001),该领域正在扩展到生物质收获领域 (胡 和 胡, 2014; Fraga-García et al., 2018)。
食品和饮料行业的应用和前景
磁性纳米颗粒也可用于食品工业。在葡萄酒和啤酒加工的大型发酵过程中去除酵母非常有趣。与传统技术相比,磁性去除酵母是一种经济高效且简单的过程,传统技术将酵母冷冻和爆炸 (Dauer 和 Dunlop,1991 年; Berovic 等人,2014 年)。Berovic 等人展示了一种磁性酵母去除工艺,该工艺将去除时间从 60 天缩短到 15 分钟,同时保持口味标准(Berovic 等人,2014 年)。通过将酵母细胞固定在磁性纳米颗粒 (Genisheva 等人,2011 年)。此外,去除葡萄酒中的浑浊、浑浊蛋白和不需要的味道是一个有趣的应用领域(Safarik 等人,2007 年; Mierczynska-Vasilev 等人,2017 年).磁性纳米颗粒上的聚合物涂层可用于去除葡萄酒中的蛋白质,而不会影响味道和风味 (Mierczynska-Vasilev 等人,2017 年)。Liang 等人展示了使用聚合物包被的磁性纳米颗粒 (Liang et al., 2018)。除了酒精饮料的精制外,磁性纳米颗粒上的固定酶还可用于食品工业中果汁的澄清(Mosafa 等人,2014 年)。
磁分离工艺的另一个重要领域是乳制品行业。分离和纯化乳清蛋白(如牛血清白蛋白、溶菌酶、乳铁蛋白、乳过氧化物酶、α-乳白蛋白和 β-乳球蛋白)的几种方法存在于实验室规模,并已被Nicolás 等人 (2019)。虽然许多研究看起来相当有希望,但我们想强调毫升级以外的加工规模。为了净化乳清,Heebøll-Nielsen 等人率先引入了高梯度磁捕法 (Heebøll-Nielsen 等人,2004 年b)。他们能够分别用磁性阳离子交换珠从 375 至 174 mL 乳清中捕获溶菌酶和乳过氧化物酶 (Heebøll-Nielsen 等人,2004 年)。对乳清的磁性加工进行了进一步的研究Meyer 等人 (2005,2007)。他们用金属离子配位磁珠 (Meyer 等人,2005 年)。此外,引入了大量的乳清来纯化蛋白质乳铁蛋白。在这里,用 HGMF 处理 2,200 mL 乳清,用聚戊二醛包被的硅烷化磁珠纯化 111 mg 乳铁蛋白。进一步的加工步骤是在 2 L 乳清原料批次 (Brown 等人,2013 年)。食品和生物技术边缘的类似磁性分离方法是从豆类提取物中纯化凝集素,从鸡蛋清中纯化溶菌酶 (Heebøll-Nielsen 等人,2004 年a; Eichholz 等人,2011 年)。
结论和展望
这篇综述提供了对行业相关磁性生物分离过程的见解。此外,我们列出了设计磁分离工艺时要考虑的所有相关因素。我们想强调磁分离技术仍未开发的潜力,该技术可应用于制药、营养和医药部门等的工业下游加工。磁性分离可能有助于克服下游工艺中的主要挑战:(1) 回收步骤中更可持续的生物工艺和环保的洗脱介质;(2) 减少水量以提高浓度因子并减少用水量。磁性分离可以作为从粗细胞肉汤中直接捕获和浓缩的步骤来实现。可能需要其他技术来进一步精纯蛋白质并提高药物靶产品的纯度。然而,目标要求、磁性吸附剂、加工条件和隔膜设计会相互影响。
大多数关于色谱材料和磁珠增强的研究仅寻求改善结合行为。因此,更好地了解吸附机制,但更重要的是了解解吸步骤是必要的。虽然色谱法在工业下游工艺中被广泛接受,但需要建立磁分离作为替代方案。在这方面,FDA 对作为食品添加剂的氧化铁及其在医疗应用中的应用的法规也将简化对工业生物分离工艺的接受。最重要的因素可能是鼓励针对不同生物技术目标设计和工程改进的系统。目前,选择一种用于生物分子磁性分离的设备很困难。必须投入更多精力来开发现代设备,学习尖端技术,应用不那么保守但更具活力的工业方法。这可能是在下游加工应用的第一和中期将磁分离确立为传统纯化方法的工业替代方案的最大挑战。
磁选系统坚固耐用,运行成本低。从磁性分离过程中常用的磁性微珠转变为具有更高比表面积和更低生产成本的纳米颗粒,可能会为更有利的加工策略铺平道路。此外,设置设计可能非常简单,但加工复杂度较低。这些优势将为未来的大规模下游加工带来创新的、具有工业吸引力的工艺。磁性分离还可以提高目标分子的生产率并降低产品价格,从而增加生物技术来源产品的数量。总之,我们希望鼓励更多使用磁力的研究和技术处理,特别是对于其他生命科学领域,例如食品和饮料行业。
Author Contributions
SS and PF-G planned and designed the manuscript. SS, PF-G, and ME collected and reviewed the literature. SB and TB discussed the manuscript. The manuscript was written through contributions of all authors. All authors have given approval to the final version of the manuscript.
Conflict of Interest
The authors declare that the research was conducted in the absence of any commercial or financial relationships that could be construed as a potential conflict of interest.
Acknowledgments
We appreciate support from the German Research Foundation (DFG) and the Technical University of Munich (TUM) in the framework of the Open-Access Publishing Program.
References
Ahoranta, M., Lehtonen, J., and Mikkonen, R. (2002). Open gradient magnetic separation utilizing NbTi, Nb3Sn and Bi-2223 materials. Supercond. Sci. Technol. 15, 1421–1426. doi: 10.1088/0953-2048/15/10/310
Albert, R. V., and Tien, C. (1985). Particle collection in magnetically stabilized fluidized filters. AIChE J. 31, 288–295. doi: 10.1002/aic.690310216
Ali, A., Zafar, H., Zia, M., Ul Haq, I., Phull, A. R., Ali, J. S., et al. (2016). Synthesis, characterization, applications, and challenges of iron oxide nanoparticles. Nanotechnol. Sci. Appl. 9, 49–67. doi: 10.2147/NSA.S99986
Auffan, M., Rose, J., Bottero, J.-Y., Lowry, G. V., Jolivet, J.-P., and Wiesner, M. R. (2009). Towards a definition of inorganic nanoparticles from an environmental, health and safety perspective. Nat. Nanotechnol. 4, 634–641. doi: 10.1038/nnano.2009.242
Becker, J. S., Thomas, O. R. T., and Franzreb, M. (2009). Protein separation with magnetic adsorbents in micellar aqueous two-phase systems. Sep. Purif. Technol. 65, 46–53. doi: 10.1016/j.seppur.2008.05.017
Berensmeier, S. (2006). Magnetic particles for the separation and purification of nucleic acids. Appl. Microbiol. Biotechnol. 73, 495–504. doi: 10.1007/s00253-006-0675-0
Bergemann, C., Müller-Schulte, D., Oster, J., Brassard, L., and Lübbe, A.S. (1999). Magnetic ion- exchange nano- and microparticles for medical, biochemical and molecular biological applications. J. Magn. Magn. Mater. 194, 45–52. doi: 10.1016/S0304-8853(98)00554-X
Berger, M., Castelino, J., Huang, R., Shah, M., and Austin, R. H. (2001). Design of a microfabricated magnetic cell separator. Electrophoresis 22, 3883–3892. doi: 10.1002/1522-2683(200110)22:183.0.CO;2-4
Berovic, M., Berlot, M., Kralj, S., and Makovec, D. (2014). A new method for the rapid separation of magnetized yeast in sparkling wine. Biochem. Eng. J. 88, 77–84. doi: 10.1016/j.bej.2014.03.014
Berret, J.-F., Sandre, O., and Mauger, A. (2007). Size distribution of superparamagnetic particles determined by magnetic sedimentation. Langmuir 23, 2993–2999. doi: 10.1021/la061958w
Borlido, L., Azevedo, A. M., Roque, A. C. A., and Aires-Barros, M. R. (2013). Magnetic separations in biotechnology. Biotechnol. Adv. 31, 1374–1385. doi: 10.1016/j.biotechadv.2013.05.009
Brechmann, N. A., Eriksson, P.-O., Eriksson, K., Oscarsson, S., Buijs, J., Shokri, A., et al. (2019). Pilot-scale process for magnetic bead purification of antibodies directly from non-clarified CHO cell culture. Biotechnol. Prog. 35:e2775. doi: 10.1002/btpr.2775
Brown, G. N., Müller, C., Theodosiou, E., Franzreb, M., and Thomas, O. R. T. (2013). Multi-cycle recovery of lactoferrin and lactoperoxidase from crude whey using fimbriated high-capacity magnetic cation exchangers and a novel “rotor-stator” high-gradient magnetic separator. Biotechnol. Bioeng. 110, 1714–1725. doi: 10.1002/bit.24842
Bucak, S., Jones, D. A., Laibinis, P. E., and Hatton, T. A. (2003). Protein separations using colloidal magnetic nanoparticles. Biotechnol. Prog. 19, 477–484. doi: 10.1021/bp0200853
Buck, M. R., and Schaak, R. E. (2013). Emerging strategies for the total synthesis of inorganic nanostructures. Angew. Chem. Int. Ed. 52, 6154–6178. doi: 10.1002/anie.201207240
Carta, G., and Jungbauer, A. (2010). Protein Chromatography: Process Development and Scale-Up. Weinheim: Wiley-VCH Verlag GmbH and Co. KGaA. doi: 10.1002/9783527630158
Charles, S. W. (1990). Alignment of biological assemblies using magnetic fluids — A review. J. Magn. Magn. Mater. 85, 277–284. doi: 10.1016/0304-8853(90)90066-Y
Chen, Q., Di, L., Zielinski, J., Kozubowski, L., Lin, J., Wang, M., et al. (2017). Yeast cell fractionation by morphology in dilute ferrofluids. Biomicrofluidics 11, 64102. doi: 10.1063/1.5006445
Conde, J., Dias, J. T., Grazú, V., Moros, M., Baptista, P. V., and de La Fuente, J. M. (2014). Revisiting 30 years of biofunctionalization and surface chemistry of inorganic nanoparticles for nanomedicine. Front. Chem. 2:48. doi: 10.3389/fchem.2014.00048
Dauer, R. R., and Dunlop, E. H. (1991). High gradient magnetic separation of yeast. Biotechnol. Bioeng. 37, 1021–1028. doi: 10.1002/bit.260371106
Ditsch, A., Lindenmann, S., Laibinis, P. E., Wang, D. I. C., and Hatton, T. A. (2005). High-gradient magnetic separation of magnetic nanoclusters. Ind. Eng. Chem. Res. 44, 6824–6836. doi: 10.1021/ie048841s
Dong, T., Yang, L., Zhu, M., Liu, Z., Sun, X., Yu, J., et al. (2015). Removal of cadmium(II) from wastewater with gas-assisted magnetic separation. Chem. Eng. J. 280, 426–432. doi: 10.1016/j.cej.2015.05.066
Ebeler, M., Pilgram, F., Wolz, K., Grim, G., and Franzreb, M. (2018). Magnetic separation on a new level: characterization and performance prediction of a cGMP compliant “Rotor-Stator” high- gradient magnetic separator. Biotechnol. J. 13:1700448. doi: 10.1002/biot.201700448
Egesa, D., Chuck, C. J., and Plucinski, P. (2017). Multifunctional role of magnetic nanoparticles in efficient microalgae separation and catalytic hydrothermal liquefaction. ACS Sust. Chem. Eng. 6, 991–999. doi: 10.1021/acssuschemeng.7b03328
Eichholz, C., Silvestre, M., Franzreb, M., and Nirschl, H. (2011). Recovery of lysozyme from hen egg white by selective magnetic cake filtration. Eng. Life Sci. 11, 75–83. doi: 10.1002/elsc.201000121
Eskandarpour, A., Iwai, K., and Asai, S. (2009). Superconducting magnetic filter: Performance, recovery, and design. IEEE Trans. Appl. Supercond. 19, 84–95. doi: 10.1109/TASC.2009.2014567
Fields, C., Li, P., O'Mahony, J. J., and Lee, G. U. (2016). Advances in affinity ligand-functionalized nanomaterials for biomagnetic separation. Biotechnol. Bioeng. 113, 11–25. doi: 10.1002/bit.25665
Fraga García, P., Brammen, M., Wolf, M., Reinlein, S., Freiherr von Roman, M., and Berensmeier, S. (2015). High-gradient magnetic separation for technical scale protein recovery using low cost magnetic nanoparticles. Sep. Purif. Technol. 150, 29–36. doi: 10.1016/j.seppur.2015.06.024
Fraga-García, P., Kubbutat, P., Brammen, M., Schwaminger, S., and Berensmeier, S. (2018). Bare iron oxide nanoparticles for magnetic harvesting of microalgae: from interaction behavior to process realization. Nanomaterials 8:E292. doi: 10.3390/nano8050292
Franzreb, M., Höll, W., and Hoffmann, C. (2004). High Gradient Magnetic Separator. Washington, DC: U.S. Patent and Trademark Office.
Franzreb, M., and Reichert, C. (2006). High Gradient Magnetic Separator. Munich: Deutsches Patent- und Markenamt.
Franzreb, M., Siemann-Herzberg, M., Hobley, T. J., and Thomas, O. R. T. (2006). Protein purification using magnetic adsorbent particles. Appl. Microbiol. Biotechnol. 70, 505–516. doi: 10.1007/s00253-006-0344-3
Ge, W., Encinas, A., Araujo, E., and Song, S. (2017). Magnetic matrices used in high gradient magnetic separation (HGMS): a review. Results Phys. 7, 4278–4286. doi: 10.1016/j.rinp.2017.10.055
Genisheva, Z., Mussatto, S. I., Oliveira, J. M., and Teixeira, J. A. (2011). Evaluating the potential of wine-making residues and corn cobs as support materials for cell immobilization for ethanol production. Ind. Crops Prod. 34, 979–985. doi: 10.1016/j.indcrop.2011.03.006
Gomes, C. S., Fashina, A., Fernández-Castané, A., Overton, T. W., Hobley, T. J., Theodosiou, E., et al. (2018). Magnetic hydrophobic-charge induction adsorbents for the recovery of immunoglobulins from antiserum feedstocks by high-gradient magnetic fishing. J. Chem. Technol. Biotechnol. 93, 1901–1915. doi: 10.1002/jctb.5599
Gómez-Pastora, J., Bringas, E., and Ortiz, I. (2014). Recent progress and future challenges on the use of high performance magnetic nano-adsorbents in environmental applications. Chem. Eng. J. 256, 187–204. doi: 10.1016/j.cej.2014.06.119
Gómez-Pastora, J., Xue, X., Karampelas, I. H., Bringas, E., Furlani, E. P., and Ortiz, I. (2017). Analysis of separators for magnetic beads recovery: from large systems to multifunctional microdevices. Sep. Purif. Technol. 172, 16–31. doi: 10.1016/j.seppur.2016.07.050
Heebøll-Nielsen, A., Dalkiaer, M., Hubbuch, J. J., and Thomas, O. R. T. (2004a). Superparamagnetic adsorbents for high-gradient magnetic fishing of lectins out of legume extracts. Biotechnol. Bioeng. 87, 311–323. doi: 10.1002/bit.20116
Heebøll-Nielsen, A., Justesen, S. F. L., Hobley, T. J., and Thomas, O. R. T. (2004c). Superparamagnetic cation–exchange adsorbents for bioproduct recovery from crude process liquors by high-gradient magnetic fishing. Sep. Sci. Technol. 39, 2891–2914. doi: 10.1081/SS-200028791
Heebøll-Nielsen, A., Justesen, S. F. L., and Thomas, O. R. T. (2004b). Fractionation of whey proteins with high-capacity superparamagnetic ion-exchangers. J. Biotechnol. 113, 247–262. doi: 10.1016/j.jbiotec.2004.06.008
Hoffmann, C., and Franzreb, M. (2004a). A novel repulsive-mode high gradient magnetic separator. Part I. Design and experimental results. IEEE Trans. Magn. 40, 456–461. doi: 10.1109/TMAG.2004.824124
Hoffmann, C., and Franzreb, M. (2004b). A novel repulsive-mode high-gradient magnetic separator. Part II. Separation model. IEEE Trans. Magn. 40, 462–468. doi: 10.1109/TMAG.2004.824121
Hoffmann, C., Franzreb, M., and Holl, W. H. (2002). A novel high-gradient magnetic separator (HGMS) design for biotech applications. IEEE Trans. Appl. Supercond. 12, 963–966. doi: 10.1109/TASC.2002.1018560
Holschuh, K., and Schwämmle, A. (2005). Preparative purification of antibodies with protein A—an alternative to conventional chromatography. J. Magn. Magn. Mater. 293, 345–348. doi: 10.1016/j.jmmm.2005.02.050
Hu, S.-H., and Hu, S.-C. (2014). Kinetics of ionic dyes adsorption with magnetic-modified sewage sludge. Environ. Prog. Sust. Energy 33, 905–912. doi: 10.1002/ep.11872
Hubbuch, J. J., Matthiesen, D. B., Hobley, T. J., and Thomas, O. R. (2001). High gradient magnetic separation versus expanded bed adsorption: a first principle comparison. Bioseparation 10, 99–112. doi: 10.1023/A:1012034923621
Hubbuch, J. J., and Thomas, O. R. (2002). High-gradient magnetic affinity separation of trypsin from porcine pancreatin. Biotechnol. Bioeng. 79, 301–313. doi: 10.1002/bit.10285
Hultgren, A., Tanase, M., Chen, C. S., and Reich, D. H. (2004). High-yield cell separations using magnetic nanowires. IEEE Trans. Magn. 40, 2988–2990. doi: 10.1109/TMAG.2004.830406
Kampeis, P., Bewer, M., and Rogin, S. (2009). Einsatz von Magnetfiltern in der Bioverfahrenstechnik Teil 1: Vergleich verschiedener Verfahren zum Rückspülen der Magnetfilter. Chem. Ing. Tech. 81, 275–281. doi: 10.1002/cite.200800121
Kampeis, P., Feind, D., and Liebland, M. (2013). Device for Separating Magnetic or Magnetizable Microparticles From a Suspension by Means of High Gradient Magnetic Separation. Munich: Europäisches Patentamt.
Kampeis, P., Lieblang, M., and Krause, H.-J. (2011). Einsatz von Magnetfiltern in der Bioverfahrenstechnik. Teil 3 - Neues Messverfahren zur Quantifizierung von Magnetbeads in strömenden Suspensionen. Chem. Ing. Tech. 83, 851–857. doi: 10.1002/cite.201000191
Kim, S., Okimoto, Y., Murase, S., Noguchi, S., and Okada, H. (2009). Characteristics of magnetic separation for magnetic particle and ion by magnetic chromatography with novel magnetic column. IEEE Trans. Appl. Supercond. 19, 2152–2156. doi: 10.1109/TASC.2009.2019143
Kronick, P., Campbell, G., and Joseph, K. (1978). Magnetic microspheres prepared by redox polymerization used in a cell separation based on gangliosides. Science 200, 1074–1076. doi: 10.1126/science.653356
Küster, F. W. (1902). Elektromagnetische Aufbereitung. Z. Anorg. Chem. 33, 377. doi: 10.1002/zaac.19030330157
Las Cuevas, G., de Faraudo, J., and Camacho, J. (2008). Low-gradient magnetophoresis through field-induced reversible aggregation. J. Phys. Chem. C 112, 945–950. doi: 10.1021/jp0755286
Laurent, S., Forge, D., Port, M., Roch, A., Robic, C., Vander Elst, L., et al. (2008). Magnetic iron oxide nanoparticles: synthesis, stabilization, vectorization, physicochemical characterizations, and biological applications. Chem. Rev. 108, 2064–2110. doi: 10.1021/cr068445e
Li, W., Yang, L., Liu, H., Li, X., Liu, Z., Wang, F., et al. (2014). Rapid and large-scale separation of magnetic nanoparticles by low-field permanent magnet with gas assistance. AIChE J. 60, 3101–3106. doi: 10.1002/aic.14533
Li, W., Yang, L., Wang, F., Zhou, H., Xing, H., Li, X., et al. (2013). Gas-assisted superparamagnetic extraction for potential large-scale separation of proteins. Ind. Eng. Chem. Res. 52, 4290–4296. doi: 10.1021/ie3031696
Liang, C., Ristic, R., Jiranek, V., and Jeffery, D. W. (2018). Chemical and sensory evaluation of magnetic polymers as a remedial treatment for elevated concentrations of 3-isobutyl-2- methoxypyrazine in cabernet sauvignon grape must and wine. J. Agric. Food Chem. 66, 7121–7130. doi: 10.1021/acs.jafc.8b01397
Lindner, J., and Nirschl, H. (2014). A hybrid method for combining high-gradient magnetic separation and centrifugation for a continuous process. Sep. Purif. Technol. 131, 27–34. doi: 10.1016/j.seppur.2014.04.019
Liu, G., Gao, J., Ai, H., and Chen, X. (2013). Applications and potential toxicity of magnetic iron oxide nanoparticles. Small 9, 1533–1545. doi: 10.1002/smll.201201531
Liu, Z., Yang, L., Dong, T., Li, W., Sun, X., Zhu, M., et al. (2016). Gas-assisted magnetic separation for the purification of proteins in batch systems. Particuology 24, 170–176. doi: 10.1016/j.partic.2014.12.015
Lu, A.-H., Salabas, E. L., and Schüth, F. (2007). Magnetic nanoparticles: Synthesis, protection, functionalization, and application. Angew. Chem. Int. Ed. 46, 1222–1244. doi: 10.1002/anie.200602866
Melville, D., Paul, F., and Roath, S. (1975). Direct magnetic separation of red cells from whole blood. Nature 255:706. doi: 10.1038/255706a0
Meyer, A., Berensmeier, S., and Franzreb, M. (2007). Direct capture of lactoferrin from whey using magnetic micro-ion exchangers in combination with high-gradient magnetic separation. React. Funct. Polym. 67, 1577–1588. doi: 10.1016/j.reactfunctpolym.2007.07.038
Meyer, A., Hansen, D. B., Gomes, C. S., Hobley, T. J., Thomas, O. R., and Franzreb, M. (2005). Demonstration of a strategy for product purification by high-gradient magnetic fishing: recovery of superoxide dismutase from unconditioned whey. Biotechnol. Prog. 21, 244–254. doi: 10.1021/bp049656c
Mierczynska-Vasilev, A., Boyer, P., Vasilev, K., and Smith, P. A. (2017). A novel technology for the rapid, selective, magnetic removal of pathogenesis-related proteins from wines. Food Chem. 232, 508–514. doi: 10.1016/j.foodchem.2017.04.050
Miltenyi, S., and Schmitz, J. (2000). “High gradient magnetic cell sorting,” in Flow Cytometry and Cell Sorting, ed A. Radbruch (Berlin: Springer), 218–247. doi: 10.1007/978-3-662-04129-1_20
Moeser, G. D., Roach, K. A., Green, W. H., Alan Hatton, T., and Laibinis, P. E. (2004). High - gradient magnetic separation of coated magnetic nanoparticles. AIChE J. 50, 2835–2848. doi: 10.1002/aic.10270
Moffat, G., Williams, R. A., Webb, C., and Stirling, R. (1994). Selective separations in environmental and industrial processes using magnetic carrier technology. Miner. Eng. 7, 1039–1056. doi: 10.1016/0892-6875(94)90032-9
Molday, R. S., Yen, S. P., and Rembaum, A. (1977). Application of magnetic microspheres in labelling and separation of cells. Nature 268, 437–438. doi: 10.1038/268437a0
Mosafa, L., Shahedi, M., and Moghadam, M. (2014). Magnetite nanoparticles immobilized pectinase: preparation, characterization and application for the fruit juices clarification. J. Chin. Chem. Soc. 61, 329–336. doi: 10.1002/jccs.201300347
Müller, C., Heidenreich, E., Franzreb, M., and Frankenfeld, K. (2015). Purification of equine chorionic gonadotropin (eCG) using magnetic ion exchange adsorbents in combination with high- gradient magnetic separation. Biotechnol. Prog. 31, 78–89. doi: 10.1002/btpr.2007
Müller, C., Preusser-Kunze, A., Wagner, K., and Franzreb, M. (2011). Gonadotropin purification from horse serum applying magnetic beads. Biotechnol. J. 6, 392–395. doi: 10.1002/biot.201000380
Mykhaylyk, O., Lerche, D., Vlaskou, D., Schoemig, V., Detloff, T., Krause, D., et al. (2015). Magnetophoretic velocity determined by space- and time-resolved extinction profiles. IEEE Magn. Lett. 6, 1–4. doi: 10.1109/LMAG.2015.2474306
Nicolás, P., Ferreira, M. L., and Lassalle, V. (2019). A review of magnetic separation of whey proteins and potential application to whey proteins recovery, isolation and utilization. J. Food Eng. 246, 7–15. doi: 10.1016/j.jfoodeng.2018.10.021
Nirschl, H., and Keller, K. (2014). Upscaling of Bio-Nano-Processes: Selective Bioseparation by Magnetic Particles. Berlin;Heidelberg: s.l. Springer Berlin Heidelberg.
Ohara, T., Kumakura, H., and Wada, H. (2001). Magnetic separation using superconducting magnets. Phys. C 357–360, 1272–1280. doi: 10.1016/S0921-4534(01)00530-5
Paulus, A., Fischer, I., Hobley, T. J., and Franzreb, M. (2014). Use of continuous magnetic extraction for removal of feedstock contaminants in flow-through mode. Sep. Purif. Technol. 127, 174–180. doi: 10.1016/j.seppur.2014.02.041
Philippova, O., Barabanova, A., Molchanov, V., and Khokhlov, A. (2011). Magnetic polymer beads: recent trends and developments in synthetic design and applications. Eur. Polym. J. 47, 542–559. doi: 10.1016/j.eurpolymj.2010.11.006
Pušnik, K., Peterlin, M., Cigić, I. K., Marolt, G., Kogej, K., Mertelj, A., et al. (2016). Adsorption of amino acids, aspartic acid, and lysine onto iron-oxide nanoparticles. J. Phys. Chem. C 120, 14372–14381. doi: 10.1021/acs.jpcc.6b03180
Robinson, P. J., Dunnill, P., and Lilly, M. D. (1973). The properties of magnetic supports in relation to immobilized enzyme reactors. Biotechnol. Bioeng. 15, 603–606. doi: 10.1002/bit.260150318
Rosensweig, R. E., and Ciprios, G. (1991). Magnetic liquid stabilization of fluidization in a bed of nonmagnetic spheres. Powder Technol. 64, 115–123. doi: 10.1016/0032-5910(91)80011-7
Roth, H.-C., Prams, A., Lutz, M., Ritscher, J., Raab, M., and Berensmeier, S. (2016). A high-gradient magnetic separator for highly viscous process liquors in industrial biotechnology. Chem. Eng. Technol. 39, 469–476. doi: 10.1002/ceat.201500398
Roth, H.-C., Schwaminger, S. P., Schindler, M., Wagner, F. E., and Berensmeier, S. (2015). Influencing factors in the Co-precipitation process of superparamagnetic iron oxide nano particles: a model based study. J. Magn. Magn. Mater. 377, 81–89. doi: 10.1016/j.jmmm.2014.10.074
Safarik, I., Ptácková, L., and Safariková, M. (2001). Large-scale separation of magnetic bioaffinity adsorbents. Biotechnol. Lett. 23, 1953–1956. doi: 10.1023/A:1013742002533
Safarik, I., Rego, L. F. T., Borovska, M., Mosiniewicz-Szablewska, E., Weyda, F., and Safarikova, M. (2007). New magnetically responsive yeast-based biosorbent for the efficient removal of water- soluble dyes. Enzyme Microb. Technol. 40, 1551–1556. doi: 10.1016/j.enzmictec.2006.10.034
Scherer, F., Anton, M., Schillinger, U., Henke, J., Bergemann, C., Krüger, A., et al. (2002). Magnetofection: enhancing and targeting gene delivery by magnetic force in vitro and in vivo. Gene Ther. 9, 102–109. doi: 10.1038/sj.gt.3301624
Schultz, N., Syldatk, C., Franzreb, M., and Hobley, T. J. (2007). Integrated processing and multiple re-use of immobilised lipase by magnetic separation technology. J. Biotechnol. 132, 202–208. doi: 10.1016/j.jbiotec.2007.05.029
Schwaminger, S. P., Blank-Shim, S. A., Scheifele, I., Pipich, V., Fraga-García, P., and Berensmeier, S. (2019a). Design of interactions between nanomaterials and proteins: a highly affine peptide tag to bare iron oxide nanoparticles for magnetic protein separation. Biotechnol. J. 14:e1800055. doi: 10.1002/biot.201800055
Schwaminger, S. P., Fraga-García, P., Blank-Shim, S. A., Straub, T., Haslbeck, M., Muraca, F., et al. (2019b). Magnetic one-step purification of his-tagged protein by bare iron oxide nanoparticles. ACS Omega 4, 3790–3799. doi: 10.1021/acsomega.8b03348
Shavel, A., and Liz-Marzán, L. M. (2009). Shape control of iron oxide nanoparticles. Phys. Chem. Chem. Phys. 11, 3762–3766. doi: 10.1039/b822733k
Soenen, S. J., Himmelreich, U., Nuytten, N., and Cuyper, M. de (2011). Cytotoxic effects of iron oxide nanoparticles and implications for safety in cell labelling. Biomaterials 32, 195–205. doi: 10.1016/j.biomaterials.2010.08.075
Solsona, M., Nieuwelink, A.-E., Meirer, F., Abelmann, L., Odijk, M., Olthuis, W., et al. (2018). Magnetophoretic sorting of single catalyst particles. Angew. Chem. Int. Ed. 57, 10589–10594. doi: 10.1002/anie.201804942
Svoboda, J. (1982). Magnetic flocculation and treatment of fine weakly magnetic minerals. IEEE Trans. Magn. 18, 796–801. doi: 10.1109/TMAG.1982.1061815
Svoboda, J., and Fujita, T. (2003). Recent developments in magnetic methods of material separation. Miner. Eng. 16, 785–792. doi: 10.1016/S0892-6875(03)00212-7
Szalay, B., Tátrai, E., Nyíro, G., Vezér, T., and Dura, G. (2012). Potential toxic effects of iron oxide nanoparticles in in vivo and in vitro experiments. J. Appl. Toxicol. 32, 446–453. doi: 10.1002/jat.1779
Thanh, N. T. K. (2012). Magnetic Nanoparticles: From Fabrication to Clinical Applications. Boca Raton, Florida: CRC Press. doi: 10.1201/b11760
Valdiglesias, V., Kiliç, G., Costa, C., Fernández-Bertólez, N., Pásaro, E., Teixeira, J. P., et al. (2015). Effects of iron oxide nanoparticles: cytotoxicity, genotoxicity, developmental toxicity, and neurotoxicity. Environ. Mol. Mutagen. 56, 125–148. doi: 10.1002/em.21909
Wang, S.-K., Wang, F., Hu, Y.-R., Stiles, A. R., Guo, C., and Liu, C.-Z. (2014). Magnetic flocculant for high efficiency harvesting of microalgal cells. ACS Appl. Mater. Interfaces 6, 109–115. doi: 10.1021/am404764n
Whitesides, G. M., Kazlauskas, R. J., and Josephson, L. (1983). Magnetic separations in biotechnology. Trends Biotechnol. 1, 144–148. doi: 10.1016/0167-7799(83)90005-7
Xiao, D., Lu, T., Zeng, R., and Bi, Y. (2016). Preparation and highlighted applications of magnetic microparticles and nanoparticles: a review on recent advances. Microchim Acta 183, 2655–2675. doi: 10.1007/s00604-016-1928-y
Yavuz, C. T., Mayo, J. T., Yu, W. W., Prakash, A., Falkner, J. C., Yean, S., et al. (2006). Low-field magnetic separation of monodisperse Fe3O4 nanocrystals. Science 314, 964–967. doi: 10.1126/science.1131475
Yavuz, C. T., Prakash, A., Mayo, J. T., and Colvin, V. L. (2009). Magnetic separations: from steel plants to biotechnology. Chem. Eng. Sci. 64, 2510–2521. doi: 10.1016/j.ces.2008.11.018
Zhang, Q., Yin, T., Xu, R., Gao, W., Zhao, H., Shapter, J. G., et al. (2017). Large-scale immuno- magnetic cell sorting of T cells based on a self-designed high-throughput system for potential clinical application. Nanoscale 9, 13592–13599. doi: 10.1039/C7NR04914E
Zhou, S., Garbett, E. S., and Boucher, R. F. (1996). Gravity-enhanced magnetic (HGMS) coal cleaning. Ind. Eng. Chem. Res. 35, 4257–4263. doi: 10.1021/ie950568u
Zong, B., Meng, X., Mu, X., and Zhang, X. (2013). Magnetically stabilized bed reactors. Chin. J. Catal. 34, 61–68. doi: 10.1016/S1872-2067(11)60476-2
- 上一篇:固相增强样品制备技术净化蛋白质组样本(SP3) 2025/6/10
- 下一篇:生物磁性分离和重悬:深入探索 2025/5/30

