凝胶色谱填料发展简史 – 背后的产业发展启示
最近在梳理色谱填料知识库,特别是凝胶填料的部分,捎带深入了解了下其发展历史。一直好奇这个领域的产品为什么是瑞典人做的比较好,背后的原因是什么?好了,索性一杆子戳到底,这次把它彻底弄个明白,以史为鉴,为将来技术和产品的开发做一些指导。
写科技史、产品史和公司史需要结合不同的历史背景、人物和时间线来组合,缺一不可。本着说清楚,搞明白的精神,我们带着几个问题来的,结合问题来找答案(内容都是有出处的),根据答案结合笔者的认知和理解找启示。
1.天降奇才
回答这个问题,需要把目光投回到1926年,这年的诺贝尔化学奖颁给了瑞典人-Theodor Svedberg (特奥多尔·斯韦德贝里),作为瑞典人要拿诺贝尔奖,个人认为其实潜在比其他国家要难些,主要是为了体现权威性和公平公正,你颁奖给自己国家的人其实会有些顾虑,得服众。这位可是个传奇人物,富二代,少年不学无术,结果有一天被中学校长一顿臭骂,忽然开窍,从此开挂,发奋读书,1904年优异成绩进乌普萨拉大学,1905年就获学士学位,1907年就获得博士学位,开始留校当讲师。(注: 乌普萨拉:Uppsala,瑞典城市,位于首都斯德哥尔摩北边不远,有著名的乌普萨拉大学,同时也是目前全球最重要的色谱凝胶填料供应商Cytiva(思拓凡)的生产基地,前身为GE Healthcare, 再前为Amersham Bioscience,再再前为Pharmacia)
那时候物理化学研究得一个热点是胶体化学,他为了更好研究胶体,于1924年研制了超速离心机(Ultracentrifuge), 这东西在当时对于大分子和胶体可以说是打开了局面,起到了很大的推动作用,人们可以用这种离心机来分离纯化各种大分子和胶体了。所以1926年就拿了诺贝尔奖。

特奥多尔·斯韦德贝里 The (Theodor) Svedberg - 获奖者 | 诺贝尔奖讯
Theodor Svedberg (特奥多尔·斯韦德贝里)1926年诺贝尔化学奖获得者。
好了,故事有了开始,天降牛人,落户乌普萨拉大学。可是,这只是关于胶体和大分子的分离,跟色谱凝胶有啥关系,别急,第二位大神马上闪亮登场。
Theodor Svedberg教授拿了诺奖,这下就吸引瑞典各方优秀学子来从师优势资源汇集。 1925年,一位来自瑞典港口城市哥德堡的青年学子Arne Tiselius(阿尔内·蒂塞利乌斯)开始跟着Svedberg教授读博士。那么就让这位年轻人研究研究带电的胶体颗粒吧,没想到这位就真在这个方向开拓出了一个新的领域,创立了电泳技术,成为开山鼻祖。所谓电泳,就是带电颗粒在电场作用下,向着与其电性相反的电极移动,那么就可以利用带电粒子在电场中的移动速度不同,使物质分离,这就是电泳技术。他还利用根据这个原理设计制造的移动界面电泳仪成功分离了三种血清白蛋白,从而可以深入研究其复杂性质,从而使人们对血清蛋白的认知有了巨大进步。1930年拿到博士学位,1938年拿到乌普萨拉大学教授位置,同时在物理化学系外,创建了生物化学系。1948年,Arne Tiselius因对电泳现象和吸附分析的研究,特别是对血清蛋白复杂性质的研究而获得诺贝尔化学奖。
好,到这里慢慢接近了,电泳和色谱都属于分离科学的范畴了。
2. 意外的发现– 天时、地利、人和
1939年 二战爆发,瑞典在整个二战期间保持中立,但整个世界都在打战,物资匮乏,得想办法搞资源啊。瑞典人民喜欢往主食面包加上果酱,一开战,这个东西就匮乏了。于是瑞典糖业公司(Sockerbolaget)就找到了乌普萨拉大学的Tiselius教授,您这不是搞生物化学的大牛吗,咱们这里甜菜很多,能榨出蔗糖来,能不能从里面再搞点别的东西出来,比如果胶替代品(战争期间柑橘果胶短缺)。


1941年,23岁的Ingelman慕名加入了Tiselius教授的团队,成为研究助手。接到的任务就是从甜菜中提取果胶以替代战时短缺的柑橘果胶。无巧不成书,夏天的时候,瑞典糖业公司给Ingelman寄来很多甜菜样本,他发现这些甜菜老是黏黏的,而且提取的果胶质量总是不达标。所以说科学发现就是那么巧,进一步研究发现,样本是因为细菌污染形成黏性物质。 再进一步研究发现,确定其为肠膜明串珠菌(Leuconostoc mesenteroides)代谢蔗糖产生的葡聚糖(Dextran)这种高分子量葡萄糖聚合物并非原研究目标,但Ingelman敏锐地意识到其潜在价值。这时候正值二战热火朝天的时候,血浆奇缺,这种天然高分子量的亲水性物质刚好可以用来替代血浆中的蛋白来保持渗透压。 于是Ingelman与生理学家Anders Grönwall合作,通过动物实验(如兔子注射)发现葡聚糖不会引发抗体反应,且具有与血浆相似的生理特性。所以说有敏锐商业头脑的科学家是科技型企业成功的关键,这一偶然发现似乎与凝胶填料技术相距甚远,却成为其诞生的物质基础。
想法有了,那么接下来怎么生产和推广呢,毕竟这边只是个大学的研发机构,真正的商业化还需要专业的才行。这时候关键的公司Pharmacia(法玛西亚)出场了。
Pharmacia公司的历史可以追溯到1911年,由药剂师Gustav Felix Grönstedt在瑞典斯德哥尔摩创立,和大多数欧美大药企的发家史类似,早期主要是靠卖“神药”起家的。Pharmacia的起家产品是Phospho-Energon,类似瑞典的神奇药物“脑白金”, 作为神经营养素和治疗疲劳和神经衰弱的灵丹妙药销售。该药物主要由小牛脑、糖和牛奶制成,以粉末和片剂形式出售。Phospho-Energon多年来一直是其最赚钱的产品,好的地方就是出售的利润使该公司后来能够投资原创药物。



3.又一次的意外
前面说过瑞典糖业公司要的是果胶,所以Ingelman在意外发现葡聚糖(dextran)。为了提高dextran的成胶性,采用环氧氯丙烷进行交联,得到了一种不溶于水,但在水中溶胀的凝胶。但瑞典糖业公司对这种水不溶性凝胶不是特别感兴趣,因此Ingelma没有申请专利,但他多留个心眼,也没有公开发表相关的内容。把这种交联过的凝胶一直保留着。
接下来的重要人物, Ingelman的两位师弟Jerker Porath和Per Flodin要登场了。 Porath和Flodin于1950年代初加入Tiselius教授的研究团队,这两个年青人被安排从事利用填充柱电泳分离生物大分子,两人迅速成为好友,时常一起探讨科学问题。一起寻找合适的可以用来装柱进行分离的吸附剂(adsorbent)。 最初尝试用淀粉和纤维素等材料填充色谱柱,但由于吸附作用较大,效果不佳。

Flodin进到Pharmacia后做的一项研究工作,就是重复再现和确认前面提到的Ingelman用环氧氯丙烷交联葡聚糖的工作,由于有之前淀粉和纤维素等材料填充色谱柱进行分离的经验,Flodin马上意识到这东西值得一试。由于他和Porath还保持联系,经常讨论科学问题,而此时Porath仍在苦苦寻找合适的适合用于电泳柱分离的惰性(吸附作用小)的填充剂,两人一拍即合,再次合作。由于葡聚糖的吸附作用非常小,Porath在填充交联葡聚糖的色谱柱实验中,发现分子按大小分离的现象——大分子比小分子更快通过色谱柱,且无需电场(不同于电泳)。实验证实该凝胶能高效分离蛋白质,而且葡聚糖凝胶还可以实现对孔径的控制。两人立刻意识到这个发现的重要性,于是一头Porath在大学实验室里继续做各种实验进一步验证,而另一头,Flodin在1957年在Pharmacia内部提交了开发葡聚糖凝胶用于生物分子分离的项目申请,虽然和Pharmacia做药物开发的主业不符合,但研发总监Björn Ingelman慧眼识珠,力排众议,大力支持。于是项目立项,有钱有人了,Pharmacia公司这边负责凝胶的制备,而乌普萨拉大学那边负责蛋白质和肽的分离实验,实验进展顺利,1958年申请了两个专利,一个关于凝胶制备,一个关于关于凝胶过滤。Porath和Flodin将这一方法命名为“凝胶过滤”(Gel Filtration),也就是现在的尺寸排阻色谱(Size Exclusion Chromatography, SEC)。 Pharmacia也准备好了正式推出交联的葡聚糖产品,名字就是现在还在销售的Sephadex 分别取了Separation, Pharmacia, Dextran这三个单词的开头字母, 后续的一系列产品线命名基本都遵循这个原则。
1959年:Porath和Flodin在《Nature》发表开创性论文《Gel filtration: A method for desalting and group separation》,描述葡聚糖色谱凝胶填料快速、简单的分离特性。 同时,Pharmacia公司也在文章发表的同时,在北美市场正式推出了Sephadex产品,大受欢迎,上市的备货两周就被抢空,因为产品太抢手,整个第一年的产品都是直接空运去美国。层析凝胶填料横空出世,分离科学再次有了重大突破性进展。


从Sephadex层析凝胶填料诞生的历史回顾,我们可以发现几个关键的节点,人物,事件以及背后的逻辑关联。
1. 天降大牛需珍惜
基因的突变每个人都有,突变的方向和结果,是拼概率事件,这样才能最大化保持种群的多样性,提高极端情况下的生存概率。在稳定发展环境中要出个天才的概率是低的,所以要特别珍惜。像本文中一开始奠定基础的Theodor Svedberg正是一个极好的例子,天才和大牛往往在每个阶段或很长事件在常人看来是“怪怪”的,比如Theodor Svedberg一开始的“不学无术”,所以需要社会有足够的宽容性,才能形成孕育天才和大牛的温床。
2. 给钱,给人,给资源
有了牛人,要快速形成资源的聚集效应,给钱,给人,给资源,这样可以快速吸引众多优秀人才的聚集效应,筑巢引凤,思想碰撞后产生好的idea的概率会大幅提高,更容易出成果。但这也是把双刃剑,资源过于集中,容易形成学阀,学霸,形成小团体,反而不好。Theodor Svedberg引来Arne Tiselius, Arne Tiselius又吸引来他的一系列弟子,才能促成Sephadex的诞生,这可能也和那时候瑞典人骨子里的北欧海盗精神相关,更着重群体的民主和利益分配。
当下时代,牛人自带流量光环的话,钱,人,资源会自动聚集,形成马太效应,新型产业的起始发展到规模效应的时间会更短,迭代也会更快速。
3. 学术界和产业界的合作
老生常谈的问题了。 个人认为处于学术界和产业界中的连接点和关键人物至关重要,如本例中的Björn Ingelman,具备敏锐商业嗅觉,同时又是学术界出身的背景。同时学术界和产业界的相向而行也非常重要,学术界需要创新,不走寻常路,不能被产业界现有的技术路线和模式牵着鼻子走,但是在探出一条新路的起始阶段,对其后续发展的路径,所需资源,商业模式等需要积极引入产业界资源来合理做研判,提前规划好专利布局,利益和资源分配,时机成熟的要早上快上,抢占战略高地,对于时机尚未成熟的,要做到心中清楚需要等待哪些资源和技术路线到位,做有心人。产业界对于新的发现和路线,要有更多的开发心态,切合主业的路线如何引入,资源如何分配,对和目前主业不切合的新型技术,是体外孵化,是找合作方共同推进,还是对外license out,需要有逐步建立规范的操作体系流程。
自1959年 Sephadex 葡聚糖凝胶发明后,极大推动了色谱凝胶填料的发展,后续这个领域横向发展出不同交联分子量的葡聚糖,琼脂糖,交联琼脂糖,高流速琼脂糖等一系列不同填料基质,纵向上发展出除起始的尺寸排阻色谱(SEC)填料外的离子交换色谱(Ion-Exchange Chromatograhy, IEC)填料,亲和层析(Affinity Chromatography, AC)填料, 疏水作用层析(Hydrophobic Interaction Chromatography, HIC)和多模式(Multi-mode Chromatography MMC)等一系列结合不同配基的填料系列。
说到了1959年Pharmacia公司正式发布Sephadex 葡聚糖凝胶产品,Sephadex填料生在一个好“时代”, 1960-90年代正是分子生物学大爆发的时代, 核酸,蛋白,酶、激素和其他生物大分子,各种研究的热点,给了凝胶色谱填料最好的舞台。Pharmacia也从一家瑞典本土药企进化成全球知名的分子生物学产品公司。但是葡聚糖凝胶填料也有其“先天”的缺陷,Sephadex由交联的葡聚糖构成,富含羟基,具有极强的亲水性。这对于生物相容性而言是好事,但是其三维网络在低离子强度溶液中吸水膨胀,但在高离子强度时因外部溶液的渗透压增加,导致凝胶脱水收缩。这一过程类似于普通水凝胶的溶胀/收缩行为。
这种情况在Sephadex被改性为离子交换树脂(如DEAE-Sephadex、CM-Sephadex)后,带电荷基团进一步引入。更加严重。
在低离子强度下:
·离子交换基团去质子化/质子化(如DEAE的氨基带电);
·基团间的静电排斥力增强,导致凝胶网络扩张,加剧吸水膨胀;
·分子内排斥使得交联结构松散,孔隙增大。
在高离子强度时:
·溶液中的反离子(如Na⁺、Cl⁻)屏蔽了固定电荷间的静电排斥;
·凝胶网络收缩,孔隙缩小;
基于葡聚糖dextran凝胶填料在不同离子强度下的体积“缩放”,同时交联度较低,难以耐受较大压力和高流速的缺点,在工业化规模生产的时候就成了瓶颈了,所以从Sephadex凝胶填料刚一推出后,人们就开始积极寻找替代的基材。
4.聚丙烯酰胺凝胶
到这里,不出意外,色谱凝胶填料发展史上的另一位重磅人物要登场了,中国色谱界如雷贯耳的乌普萨拉大学的Stellan Hjertén教授。Stellan Hjertén对于层析填料和毛细管电泳技术发展都做出了巨大的贡献,可以说是分析化学里好几个方向的开山鼻祖。这里只重点讲和色谱凝胶填料相关的部分。

由于Hjertén正好在用聚丙烯酰胺凝胶进行电泳分子筛, 因此顺理成章地试试这些凝胶用于色谱分子筛。不试不要紧,一试吓一跳,非常大的蛋白质也可以通过聚丙烯酰胺凝胶过滤进行分离,效果非常好。
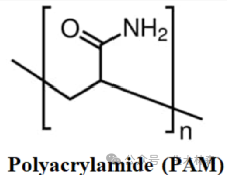
Bio-Rad Laboratories(伯乐)公司一开始是个夫妻店起家,David and Alice Schwartz夫妇都是加州伯克利大学的,毕业后开了这家公司,一开始主要提供生物分子的标记,那时候标记可主要用的放射性核素标记哦,所以Bio-Rad的 Biochemical-Radiochemical的缩写结合,看来那个时候公司和产品取名都好这口。

Schwartz夫妇和Bio-Rad早期团队
David Schwartz一直和Tiselius保持着良好的私人关系,密切关注着这个研究组的科研进展,这时候既然Pharmacia公司不感兴趣,Bio-Rad公司迅速介入,连带着之前的羟基磷灰石填料,加上聚丙烯酰胺分离介质,好东西统统都要。基于Hjertén发现的聚丙烯酰胺介质和后续开发大规模制备聚丙烯酰胺填料微球的技术,Bio-Rad公司在1964年推出了Bio-Gel® P 色谱凝胶填料 (P=polyacrylamide),从而在分析科学市场,特别是蛋白质分离市场一炮而红,成了Pharmacia公司的主要竞争对手之一。此后,Pharmacia Fine Chemicals (1967 年从Pharmacia里单独成立,专门针对非药物产品市场)(生产葡聚糖凝胶, Sephadex)和Bio-Rad(生产聚丙烯酰胺凝胶,Bio-Gel® P)之间的竞争极大促进了这些填料的持续改进。


科研中的积极心态
目前各种国产化替代的过程,基本是有已知的明确参照物,体系和参数指标的,但后续进入深水区,“无人区”,需要开拓新方向和新目标的时候,没有参照物了,这个时候积极的心态非常重要,Hjertén教授在回忆录里有句名言“如果我也参与了Dextran凝胶(Sephadex®)的开发,聚丙烯酰胺凝胶(和琼脂糖凝胶)可能永远不会被用于分子筛(这无疑会阻碍生命科学的发展)。这只是我在研究中,以及在一般生活中经验性发现的一个“规则”:一个在开始时看似消极的实验或事件,从长远来看,当从正确的角度看待它时,结合其他实验和事件,可能会带来积极的结果。”
英文里有个专门词汇对应这类现象:Serendipity ,类似中文里的“无心插柳柳成荫”。我们后续需要引领科技发展前沿的话,可能还需要多一些这样的“运气”和孕育这样运气的环境。
初创公司的突破
1950-60年代,美国出现了一批初创公司,采用一种快速、高效的商业化实验室产品的模式,Bio-Rad公司就是采用这种打法,利用聚丙烯酰胺色谱凝胶填料一战成名,让Pharmacia这个欧洲传统药企公司有点措手不及,所以后续Pharmacia把非药产品剥离出来,单独成了Pharmacia Fine Chemicals公司来应对,这才催生了后续更强大的凝胶色谱填料系列产品。
接下来是最重磅的琼脂糖凝胶填料登场,故事更加精彩。
葡聚糖和聚丙烯酰胺色谱凝胶填料的发现和产品上市,但是这两个系列填料有几个先天不足的缺点。
1.机械强度不够,无法上高压力,这就意味无法提供高流速,大规模工业应用上受限。
2.填料内部孔径还不够大, 无法分离大分子量蛋白质或生物体,如病毒或核糖体。
3.葡聚糖填料在缓冲液的离子强度变化时会膨胀或收缩。
4.聚丙烯酰胺的单体丙烯酰胺具有神经毒性,同时也是致癌物质
随着1959年葡聚糖凝胶在色谱分离的应用的文章发表后,人们开始在各种类似葡聚糖结构的糖类里淘宝,由于前面介绍的Tiselius教授的研究小组也在寻找一种与自由区带电泳实验相似的介质,即无分子筛效应的凝胶,有人报道过使用琼脂(Agar)作为凝胶来跑电泳,但由于存在带电基团,效果并不怎么好。(具体琼脂和琼脂糖的区别及它们的前世今生,也是非常有趣的故事,后续值得来个番外篇)。
但是前面介绍的大牛Hjerten教授却没轻易放弃,他研究了许多关于琼脂化学结构的文章后,了解到一位日本研究人员Choji Araki(荒山朝次)早在1937年就发现琼脂由两种多糖组成:一种带电的,他称之为琼脂糖醛酸,和一种不带电的,琼脂糖。(目前的定义:琼脂是一种与硫酸酯、丙酮酸和甲基基团不同程度取代的多糖混合物,而琼脂糖就是其中具有最低电荷含量的部分)。(其实日本人是最早研究琼脂和琼脂糖结构,结果分别被德国人和瑞典人分别截胡,做成了微生物学和分子生物学的两门大生意)。
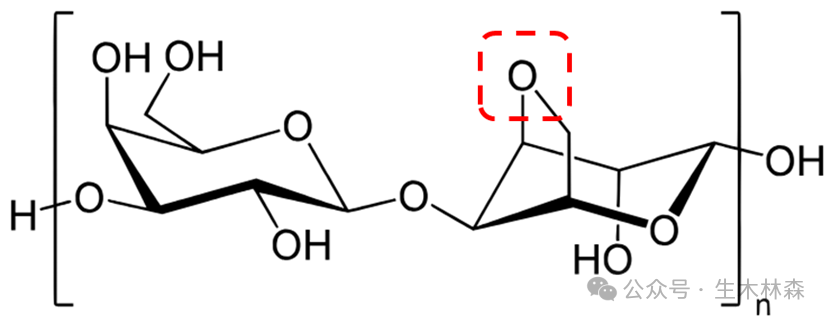
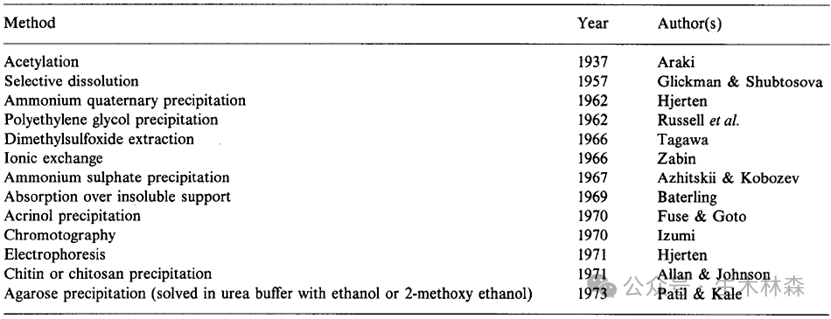
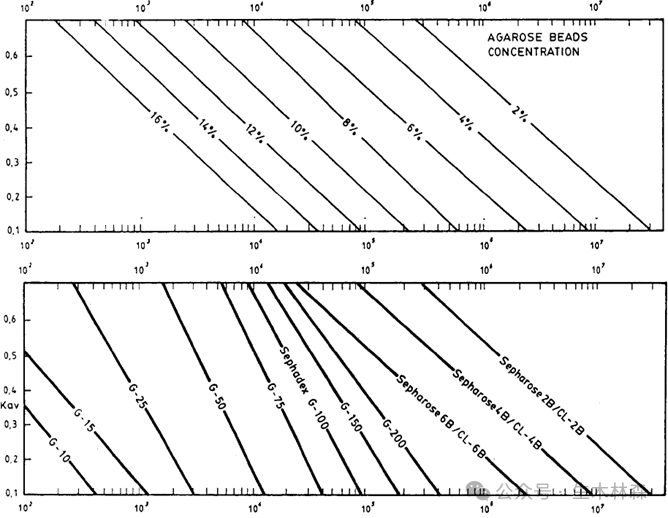
了解到琼脂和琼脂糖的不同,一下子就打开了局面,那就从琼脂里面来提取琼脂糖,从定义来说也比较直接,就是去掉琼脂里带电的部分,留下不带电或带电极少的部分。科学家开发了不少方法来干这个,如下表。
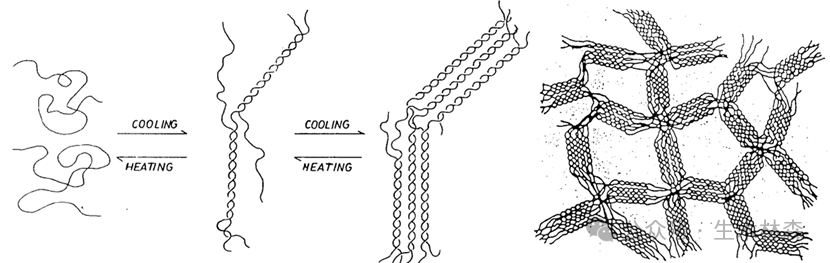
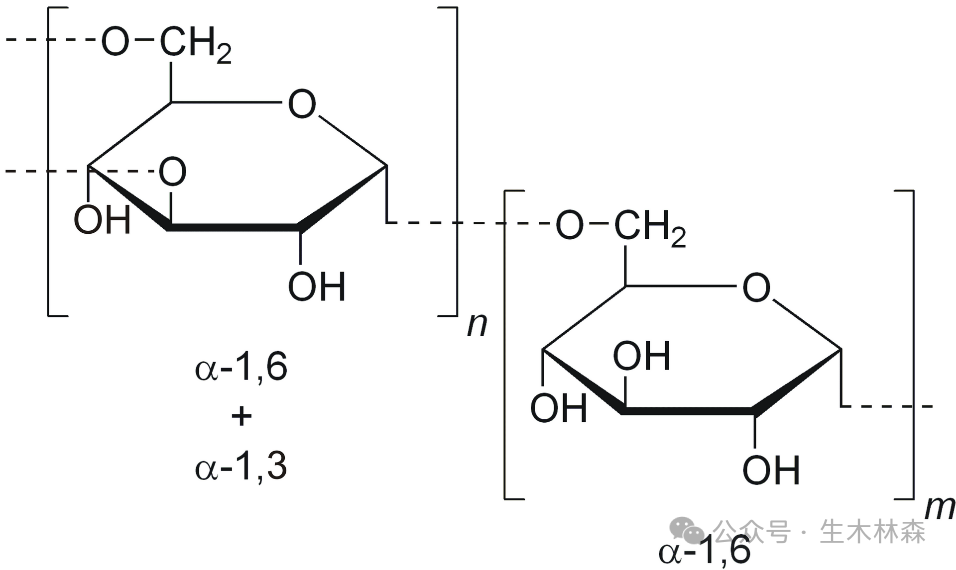
1.3,6-脱水-L-半乳糖残基中的分子内醚键(C3与C6之间的键)(上图中红色虚线圈)是凝胶化的关键,促进双螺旋结构的形成。
2.琼脂糖双螺旋通过另一组氢键聚集成三维网络纤维,围绕大量水分形成相互连接的孔隙。由于结构靠氢键支撑,所以对于高温和高盐还是会破坏琼脂糖凝胶的结构图片。琼脂糖可逆凝胶化过程:从随机线圈形成双螺旋(三级结构)并最终形成大网络结构。
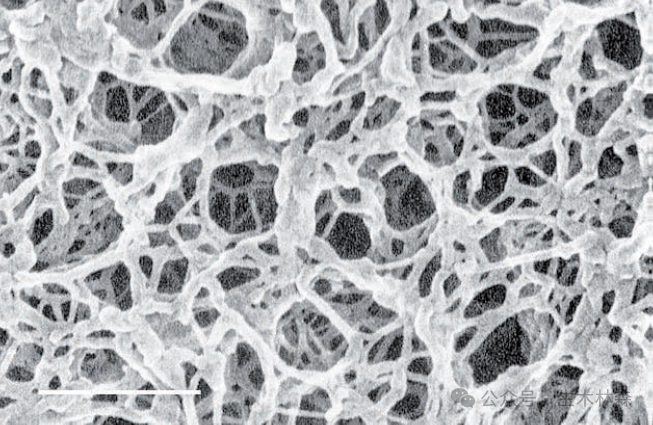
4.琼脂糖链上的羟基赋予其强亲水性,使其对蛋白质等生物分子吸附极低,适合生物分离。
5.琼脂糖凝胶的孔径随浓度增加而减小,适合大分子分离。
6.琼脂糖的羟基可通过溴化氰、环氧氯丙烷等活化,偶联配基,实现不同的功能化。
7.琼脂糖凝胶仅靠氢键所以机械强度低。通过化学交联可稳定螺旋结构,提高耐压性和耐极端pH能力。交联不改变孔径,但显著提升刚性。
8.琼脂糖相较于它的原材料琼脂而言残留的硫酸根和丙酮酸基团极少,将电内渗(electroendosmosis,EEO)的影响降至最低,所以也非常适合对带电的生物大分子的电泳分离,常见的实验室跑胶,多指的就是采用琼脂糖凝胶电泳分离带负电的核酸分子。
9.琼脂糖的结构对酶解和水解都具有比较好的抵抗力

这次Pharmacia公司不会再错过了, 马上合作,并于1967年推出了商业化销售的琼脂糖色谱凝胶微球产品,商品名为Sepharose(Separation, Pharmacia, Agarose)。如上面总结的琼脂糖的独特化学性质,难以找到具有相同或更好的色谱性能的替代品于是它们在实验室和工业生产上广受欢迎。Sepharose和基于琼脂糖微球的系列产品迅速成为Pharmacia公司利润最高的色谱填料产品—直到今天仍然是。从Sepharose推出之后,围绕琼脂糖微球填料的进一步改进和功能化就在不断进行。主要是以下几个方面:
1.交联技术的改进
l 早期交联:Porath等人(1971年)引入二溴丙醇和双环氧化合物交联,提高了机械稳定性,基于此,Pharmacia在1975年推出了形成Sepharose CL系列产品 (CL=Cross-Link, 交联)
l 盐存在下交联:Laurent和Axelsson发现高浓度盐可收缩琼脂糖纤维,促进交联剂渗透,开发出Sepharose Fast Flow系列(1985年),耐压性显著提升,为工业规模的应用铺平了道路。
l 组合交联剂:Pharmacia公司(1982年)采用短链(环氧基)和长链(碳链)双交联剂组合,推出Superose系列,孔径分布更优
l 预交联技术:在琼脂糖溶液中加入含活性/非活性基团的双功能交联剂(如烯丙基缩水甘油醚),凝胶化后激活非活性基团,实现高效交联,用于Capto系列


琼脂糖结构中有大量的羟基可以作为活化的位点,除了做交联外,也可以在活化后结合其他的功能基团,从而彻底打开琼脂凝胶填料应用的天花板。相当于利用交联的琼脂糖作为基础骨架,在上面可以接出不同功能的配基来实现基于不同模式(如电荷-离子交换,亲和,疏水,多模式等)的分离。
琼脂糖微球羟基活化主要有以下几种:
溴化氰(CNBr)活化:1967年由Axen等首次引入多糖材料活化,但存在异脲键不稳定、配基易脱落的问题。同时溴化氰有毒性。
环氧氯丙烷活化:作为CNBr的替代方案,因其低毒性和高活化率被广泛应用,但受限于其在水中的溶解度。
烯丙基缩水甘油醚活化:一端环氧基与琼脂糖羟基反应,另一端惰性双键减少副反应,同时后续可以进一步活化双键,根据需求上不同配基,大大提高了反应的可控性和灵活性。
NHS活化:对伯胺基配基偶联速度快、效率高且酰胺键在碱性条件下下稳定。
二乙烯基砜(DVS):用于羟基载体活化,偶联氨基、巯基等,但碱性条件下不稳定。
还原氨化法:通过NaIO4氧化生成醛基,与伯胺形成希夫碱后还原为稳定仲胺键,但后续容易有美拉德副反应,微球易变黄。
上述方法中加深的部分为现在比较主流应用的琼脂糖凝胶微球活化方法
3.配基修饰
羟基活化好了,接下来就结合不同的应用和分离模式来上结合不同的配基。
- 离子交换-Ion Exchanger (IEX)
阴离子交换(Anion Exchanger, AEX)
弱阴离子交换就用DEAE
阳离子交换 (Cation Exchanger, CEX)
这个一般都用磺酸基团,Sulfonate group, 所以商品名带 S
- 疏水作用(Hydrophobic Interaction Chromatography, HIC)
比如Butyl- =结合丁基 Phenyl- =结合苯环,Octyl-=结合辛基,疏水性依次增强
- 多模式作用(Multi-Mode Chromatography, MMC)
- 亲和作用 (Affinity Chromatography, AC)
Protein A是1958年在金黄色葡萄球菌Staphylococcus aureus细胞壁上发现的一种蛋白,分子量约为42 kDa,包含从N端到C端的五个同源结构域:E、D、A、B和C (每个结构域有58个氨基酸残基),每个结合域都能与多种哺乳类动物的免疫球蛋白结合,最主要为IgG。Protein A能与大多数免疫球蛋白重链的Fc区域结合,当Protein A与免疫球蛋白结合后,这些免疫球蛋白便失去了作用,进而摧毁免疫系统的吞噬作用及调理作用。这也就是金黄色葡萄球菌致病的厉害之处,惊不惊喜,意不意外,好的科学发现就是从大自然里学习,变废为宝,化害为利。更有意思的是,早期的Protein A的纯化,采用的就是我们之前提到的Sephadex色谱填料。
Protein A一经发现,马上就引起了搞凝胶色谱填料的科学家的关注,这不就是梦寐以求的亲和配基吗,刚好那段时间,Porath的团队投入了大量精力在研究如何在Sephadex凝胶微球上引入不同的蛋白和酶,1966年人们刚发现Protein A与IgG的特异性作用后,马上就利用现成的活化后引入配基的技术,把天然Protein A接到了琼脂糖微球上,形成了第一代的亲和琼脂糖色谱填料。短短一年左右,团队在Nature上前后发表了三篇相关文章,多么美好的时代。也充分说了在凝胶色谱填料固定化结合酶和各种生物活性分子的重要性和对后来分子生物学发展的推动作用。

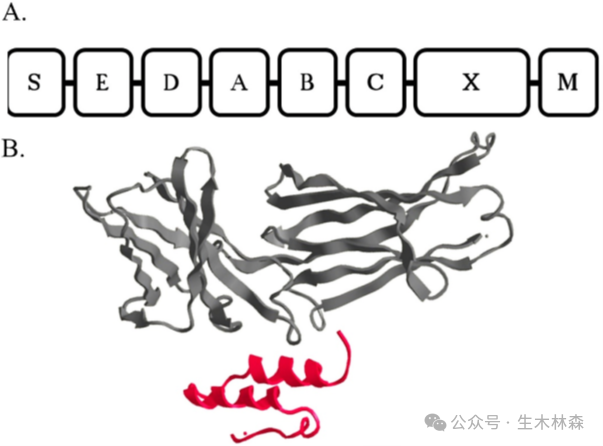
我们还是以(Pharmacia-Amersham-GE Healthcare-Cytiva)的protein A琼脂糖填料系列的发展史为例来讲。
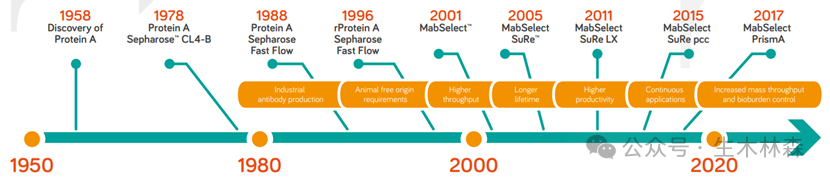
据此1996年推出了rProtein A Sepharose FF,其重组Protein A包含五个串联结构域:E、D、A、B、C。尽管去除了非结合域,仅保留五个结构域,但每个域均可与IgG的Fc段结合,且结合强度略有差异,导致洗脱条件不一致,常需要低pH值。剧烈的洗脱条件易使单抗变性、形成聚集体或复性困难,对敏感型单抗不利。
那么如果减少串联结构域的个数,并且采取同型结构域串联,应该有帮助,于是MabSelect产品于2001年诞生了,采用了B结构域的四聚体形式的重组Protein A,同时在C 端导入半胱氨酸,通过硫醚键与环氧基团活化的琼脂糖微球定向偶联,在提高结合载量的同时,也消除了不同结构域与抗体Fc 段亲和性的差异,使得洗脱条件更温和而均一。(注意:Pharmacia公司在1997年和英国的Amersham 合并成立了Amersham Pharmacia Biotech,这个产品一炮而红,让合并后的公司从以实验室产品为主趁着单抗药物发展的东风,一把杀进了工业规模,Amersham的财报年年必提MabSelect.)
但是CIP过程中的耐碱性怎么办呢,总不能清洗几个循环就不能用了,不耐碱的活,脱落的Protein A配基对于药物安全性也是个大问题。那接着对Protein A工程化改造吧, 这个时候,科学家对于B结构域的氨基酸序列已经理解比较深入了,首先人工造出了个B 结构域的功能类似物和能量最小化版本,称为Z结构域,同时替换了天冬酰胺残基(对碱最敏感的氨基酸,使蛋白质容易脱酰胺),创建了一个z结构域四聚体配体, 同时包含一个 C 端半胱氨酸,通过硫醚键和环氧化物间隔臂与高交联的琼脂糖微球进行定向偶联。这样在2005年诞生了经典的MabSelect Sure耐碱型的Protein A填料。 具有非常低的配体脱落,同时选择性定向提供了更高的结合载量。
后续的MabSelect PrismA将配基Z结构域四聚体提高为六聚体,从而进一步提高了单抗结合载量和耐碱性。
最新的Protein A凝胶填料为MabSelect PrismA X和MabSelect SuRe 70 应该也是在结合载量和耐碱性上进行提高和改进。比如琼脂糖粒径变小点,这样可以在相同体积下,增加更多的表面积来增加配基密度,从而实现更大的结合载量。或者通过延长柱内的停留时间来提高结合载量。
从琼脂糖凝胶色谱填料的发展历史,可以预见
1.琼脂糖因为其独特的化学结构导致的独特性质使其在目前各类凝胶中脱颖而出,成为最主流和工业规模应用最多的凝胶层析填料基材,后续的进一步的发展和突破需要有更优异性能的基材,在保持亲水性,生物相容性,可修饰性的基础上,在孔隙率,连通率和机械性能上实现更好好的平衡点。 现有的聚合物类的填料已经形成了冲击之势,但还需要进一步解决亲水性和生物相容性的问题。
2.固定化和偶联化学的方法已经相对比较成熟,后续发展的关键在于配基。特别针对亲和色谱,好的配基是决定成败的关键。由于琼脂糖本身的化学结构和性质的限制,同时考虑到配基与分离目标分子作用的空间位阻效应,最终的配基密度会有一个天花板。
3.新型的琼脂糖微球制备工艺,比如膜乳化造球,喷射造球,微流控通道造球等,会对传统的水/油相乳化法形成挑战和冲击。
4.非色谱柱类分离方法的挑战,因为药物生产的保守性,以及打破已有的工艺体系,重建新的工艺路线和体系的成本考量,在没有体现出较大的性能和/或经济效益之前,还需要时日,毕竟凝胶色谱填料发现,上市,从实验室规模到大规模工业应用规模,是从上世纪50年代一直持续到现在,已经接近80年的时间,需要好几代人持续不断的工作。
生物工艺产品,特别是凝胶色谱填料国产化替代之后的科技引领,新技术,新产品,新体系的打造该怎么做,希望本系列的内容能带来一些思考和启示!
- 上一篇:Mann神出手警惕血浆蛋白组学数据中可能的污染!!血浆蛋白组 2025/5/17
- 下一篇:Sp3, single-pot, solid-phase-e 2025/5/10

