抗体纯化方法简介(附示意图)
制备出效价高,特异性强,稳定性好的抗体是免疫学实验取得成功的基础,抗体质量的好坏直接影响着研究者研究的成败,不同的免疫学实验方法(如ELISA,IHC,IP,ICC,SDS-PAGE, WB等)对抗体的效价,浓度和纯度有不同的要求。我们知道,一般免疫血清中含有特异性抗体和非特异性抗体,血清蛋白以及其他各种杂蛋白等,在制备特异性抗体过程中当抗体的效价达到实验预期之后,我们所制备的抗体的纯度关键取决于所选择的纯化方法。抗体经制备后需要进一步纯化,纯的抗体有利于保存以及排除杂蛋白对结果的影响。下面就一一介绍常用抗体纯化方法及其相关原理。抗体纯化方法的选择一般取决于抗体的来源、时间的需求、成本的预算以及抗体的最终用途等。
根据纯化方式可分为以下几类:
盐析法(饱和硫酸铵沉淀法)
该纯化方法是基于在待纯化免疫血清中加入饱和硫酸铵溶液,由于抗体也是一种蛋白质,其在水溶液中的溶解度是由其本身携带的亲水基团数和电荷数决定的,当我们向抗血清中加入饱和硫酸铵溶液后,硫酸根离子和铵根离子与抗体竞争溶液中的水分子,因为硫酸根离子和铵根离子与抗体分子相比,具有更强的亲水性,因此抗体分子表面的水化膜被破坏,同时其暴露出来的带电基团被溶液中的盐离子所中和进而导致其溶解度大大降低,依据此原理从而将其从抗血清中分离。
具体实验步骤如下:
将5ml抗血清与0.01M PBS在离心管内等体积混合,向其中加入10ml饱和硫酸铵溶液,边滴加边摇匀,然后置于2到8摄氏度静置过夜。
将步骤a中的待分离物于离心机内离心,8000r/min离心15到20分钟,除上清。
将步骤b中离心后的沉淀用2ml 0.01M PBS 溶解,然后缓慢加入3ml 饱和硫酸铵溶液,边滴加边摇匀,然后置于2到8摄氏度静置2小时。
将步骤c中的待分离物于离心机内离心,8000r/min离心15到20分钟,除上清。
将步骤d中离心后的沉淀用1.65ml 0.01M PBS 溶解,然后缓慢加入3.35ml 饱和硫酸铵溶液,边滴加边摇匀,然后置于2到8摄氏度静置2小时。
将步骤e中的待分离物于离心机内离心,8000r/min离心15到20分钟,除上清。
将步骤f中离心后的沉淀用1ml 0.01M PBS 溶解, 转移到MD 14000透析袋内,用0.01 M PBS进行透析,透析4次以上,每次至少1小时以上。
正辛酸-饱和硫酸铵沉淀法
该纯化方法原理是:正辛酸在偏酸条件下,能与抗血清中或者小鼠腹水中的杂蛋白结合,在等电点附近将其沉淀,IgG类抗体则存在于上清液中,再利用饱和硫酸铵沉淀法即可进一步提纯。
具体实验步骤如下:
将抗血清或者小鼠腹水于离心机中离心15到20分钟,8000r/min,以去除其中的细胞碎片或者其他沉淀物等杂质。
将1体积的抗血清或者腹水与2体积的0.06M PH 4.8的醋酸盐缓冲液进行混合,室温下,边搅拌边缓慢加入正辛酸,加入正辛酸的量为33ul/ml抗血清或者腹水。
室温混合15到30min
2到8摄氏度静置过夜,使其充分沉淀。
8000r/min离心15到20分钟,弃去沉淀取上清。
将上清转移到MD 14000透析袋内,用0.01 M PBS进行透析,透析4次以上,每次至少1小时以上。
利用盐析法(饱和硫酸铵沉淀法)对步骤f中透析后的上清进行纯化,具体实验见上,此处不再赘述。
亲和层析法
亲和层析主要适用于从成分复杂且杂质含量远大于目标物的混合物中提纯目标物。如图所示,琼脂糖首先与介质偶联,结合成具有特异亲和性的分离介质,再加入成分复杂的混合物即样品后,配体选择性吸附生物活性物质(高亲和力抗体),加入平衡液,洗脱去除杂质,最终获得目标物。
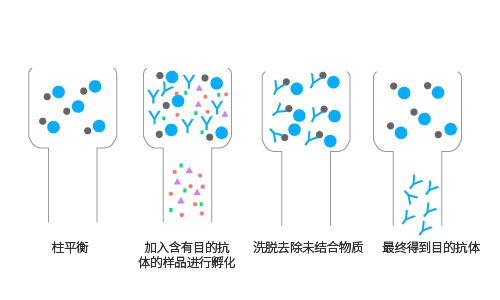
protein A/protein G亲和层析
通过基因工程改造的protein A和protein G能特异性结合哺乳动物IgG的Fc区段, 将protein A和protein G结合到柱料上,通过亲和层析的方式,可将IgG及其亚类与片段纯化出来。近年来发展的磁珠法纯化是将蛋白protein A和protein G结合到磁性载体上,通过亲和作用和磁分离的方式,将IgG及其亚类与片段纯化出来,特别适合于小量抗体的亲和纯化。厦门普睿迈格生物科技有限公司开发的蛋白A、蛋白G、蛋白L、蛋白AG磁珠均具有较好的使用效果。(可参考网页http://www.purimagbead.com/Product/0293713052.html)
● protein A:分子量为42kDa,由spa基因编码,具有5个同型的免疫球蛋白结合结构域,每个结构域由3个α螺旋构成。
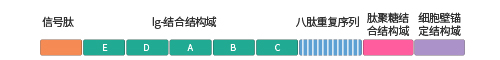
Protein A的各个结构域
● protein G:分子量为65kDa,由spg基因编码,可结合抗体的Fc段、Fab段以及血清中的白蛋白。基因工程改造的protein G去掉了与白蛋白的结合位点,仅保留Fc结合结构域,其结合力较protein A更强。

Protein G的各个结构域
● protein A/protein G:是一种基因工程结合蛋白。它由4个protein A和2个protein G免疫球蛋白结合域组成,比单独的protein A或protein G结合范围更加广泛,并将其优点融为一体,几乎可以应用于所有种属的IgG纯化。
抗原亲和纯化法
利用抗原为配体的亲和纯化称之为抗原亲和纯化,是一种高度纯化蛋白类生物大分子的有效手段。此种方法中,抗原替代亲和配体,被化学偶联在凝胶介质上,目的抗体与抗原特异性结合,最终洗脱得到目的抗体。
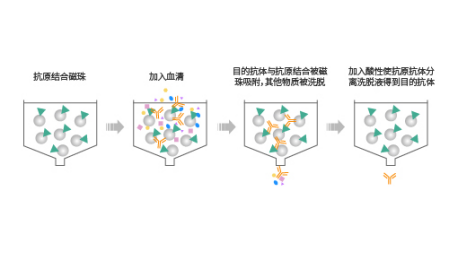
与protein A纯化法的区别在于,抗原亲和纯化是与抗体的Fv区特异性结合,protein A纯化则与抗体的Fc区特异性结合。相比较之下抗原亲和纯化能高度识别和结合目标抗体,因此常用于多抗的纯化。
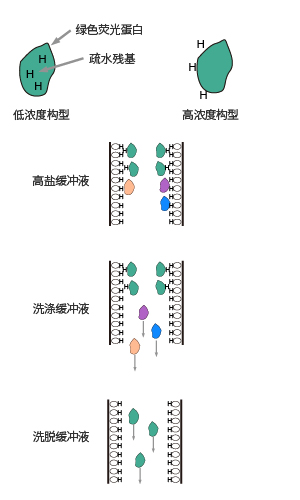
疏水作用层析法
利用盐-水体系中样品分子的疏水基团和层析介质的疏水配基之间疏水力的不同而进行分离的一种层析方法。这种方法利用被分离组分分子表面的疏水微区,变形后暴露出的疏水残基,或在高盐环境下暴露于分子表面的疏水残基与固定相的疏水性配体之间的作用强弱,依次用从高到低的离子强度洗脱液可将疏水作用由弱至强的组分分离。
离子交换法
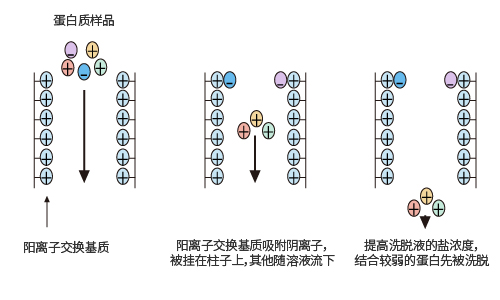
离子交换层析法是从复杂的混合物中,分离性质相似大分子的方法之一。由于蛋白质有等电点,当蛋白质处于不同的PH条件下,其带电状况也不同。阳离子交换基质结合带有负电荷的蛋白质,所以这类蛋白质被留在柱子上,然后通过提高洗脱液中的盐浓度等措施,将吸附在柱子上的蛋白质洗脱下来。结合较弱的蛋白质首先被洗脱下来。同样,阴离子交换基质结合带有正电荷的蛋白质,结合的蛋白可以通过逐步增加洗脱液中的盐浓度或是提高洗脱液的PH值洗脱下来。
尺寸排阻色谱法
尺寸排阻色谱法又称为分子排阻色谱法(SEC),主要根据凝胶孔隙的孔径大小与高分子样品分子的线团尺寸间的相对关系而对溶质进行分离的分析方法。主要用于分离分子量相差大的化合物。
原理:取决于分子在溶液中的体积,当溶液加入纯化柱时,分子会依照其在溶液中的尺寸(分子平均直径)从大到小依次分离。分子小的通过柱床流动速度相对缓慢,因为它们会不同程度的深入孔隙,而大的分子由于不能进入柱床而被快速排出,因此,通过分子体积大小洗脱样品,可以有效进行分选。
- 上一篇:客户采用我司链霉亲和素磁珠在SCI期刊《Analytical 2021/3/2
- 下一篇:临床质谱发展概况 市场前景喜人 2021/2/24
